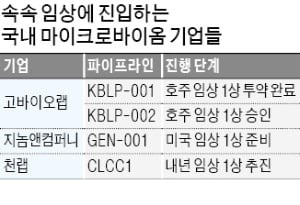
 천랩은 호주 시드니에 현지 법인을 설립했다고 1일 밝혔다. 마이크로바이옴 신약 개발을 위한 거점을 마련했다는 게 회사 측 설명이다. 호주의 의약품 수탁개발생산기관(CDMO)인 루이나바이오와 계약을 맺고 신약 후보물질 ‘CLCC1’에 대한 안전성 시험과 임상시료 생산을 추진한다. 글로벌 임상시험수탁기관(CRO) 한 곳과 임상 관련 논의도 하고 있다.
천랩은 호주 시드니에 현지 법인을 설립했다고 1일 밝혔다. 마이크로바이옴 신약 개발을 위한 거점을 마련했다는 게 회사 측 설명이다. 호주의 의약품 수탁개발생산기관(CDMO)인 루이나바이오와 계약을 맺고 신약 후보물질 ‘CLCC1’에 대한 안전성 시험과 임상시료 생산을 추진한다. 글로벌 임상시험수탁기관(CRO) 한 곳과 임상 관련 논의도 하고 있다.천랩은 지난해 마이크로바이옴 빅데이터를 통해 CLCC1을 발굴하고 전임상에서 고형암에 효과가 있다는 것을 확인했다. 황혜진 천랩 전무는 “호주는 임상시험 승인을 받기가 간편하고 임상시험 비용의 세금을 최대 43.5% 환급받을 수 있는 등 임상하기 좋은 조건을 갖추고 있는 데다 미국과 유럽에 진출하기도 용이하다”며 “내년께 호주에서 임상 1상을 추진할 계획”이라고 말했다.
고바이오랩은 호주에서 임상 1상 시험을 하고 있다. 지난 1월 피험자 36명에게 ‘KBLP-001’ 투약을 마쳤다. 임상에 진입한 국내 최초의 마이크로바이옴 신약 후보물질인 KBLP-001은 아토피, 염증성 장질환, 건선 등 자가면역 질환에 효과가 있을 것으로 회사는 기대하고 있다. 고바이오랩 관계자는 “미국 식품의약국(FDA)에 제출할 임상 2상 시험 계획을 준비하고 있다”고 했다.
지난달에는 ‘KBLP-002’의 호주 임상 1상 승인도 받았다. 이 물질은 아토피성 피부염, 천식 등 알레르기성 면역 질환에 효과가 기대되는 후보물질이다. 올해 임상 1상을 마친 뒤 내년 상반기 미국 임상 2상을 추진할 예정이다.
지놈앤컴퍼니는 마이크로바이옴 기반의 항암제를 개발하고 있다. 신약 후보물질 ‘GEN-001’과 글로벌 제약사 머크와 화이자가 공동 개발한 면역항암제 바벤시오를 병용하는 임상을 추진 중이다. 1월 머크, 화이자와 바벤시오를 임상시험용 의약품으로 무상 공급받는 계약을 체결했다. 회사 측은 100억원 상당의 임상비용을 절감할 수 있을 것으로 추정하고 있다.
전임상에서 GEN-001은 면역관문억제제와 병용했을 때 면역 기능을 활성화하는 데 뛰어난 효과를 보였다. 지놈앤컴퍼니는 FDA에 임상시험계획(IND)을 제출할 준비를 하고 있다. 올 상반기 중 임상 1상에 진입할 예정이다.
임유 기자 freeu@hankyung.com
관련뉴스














