임상 3상은 미국과 아르헤네티나 브라질 칠레 등에서 6만명의 성인을 대상으로 진행된다. 긍정적인 결과를 입증할 경우 아동까지 대상을 확대할 계획이다.
이영환 연구원은 존슨앤드존슨 백신이 다른 회사에 비해 3상 시작이 빠른 것은 아니지만, 차별화된 경쟁력이 있다고 봤다.
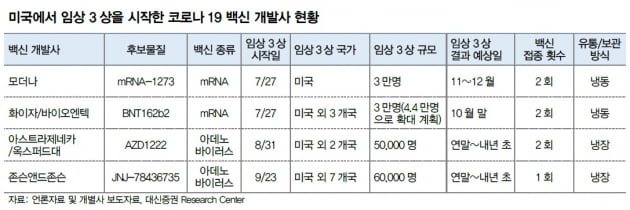
우선 1회 접종 백신이라는 점에 주목했다. 모더나 화이자 아스트라제네카 등의 백신은 일정 기간을 두고 2회 접종이 필요하다. 1회 접종으로 면역 효과가 나타난다면 백신 물량과 접종기간을 절반으로 단축할 수 있다.
냉장 보관이 가능하다는 것도 장점이다. 모더나와 화이자의 백신은 냉동 보관이 필요하지만 존슨앤드존슨과 아스트라제네카는 냉장보관이 가능하다. 냉장 보관 방식은 유통 과정이 냉동 보관 방식에 비해 덜 까다롭다.
존슨앤드존슨 백신의 예상 보관 가능 기간은 2~8도에서 최소 3개월, 영하 20도에서 2년이다.
임상 3상 목표 인원이 6만명으로 가장 많다는 점도 긍정적으로 해석했다. 아스트라제네카 5만명, 화이자 4만4000명에 비해 규모가 크다. 존슨앤드존슨의 임상 시작일은 경쟁사에 비해 1~2달 늦다. 하지만 임상 대상자 수가 가장 많고 여러 연구기관와 협력이 가능해 더 많은 실험을 통해 부작용 발생 가능성을 낮출 수 있다고 봤다.
코로나19 백신의 출시는 오는 11월 이전에는 불가능하다는 판단이다. 미국 식품의약국(FDA)이 코로나19 백신의 긴급승인 요건을 강화할 것으로 예상되기 때문이다. FDA는 2차 백신을 투약한 이후 최소 2개월간 데이터를 추적하고, 위약 투여군에 최소 5명의 중증 환자를 포함한다는 기준을 긴급승인 요건에 추가할 예정이다.
이 연구원은 “미국 대통령 선거일인 11월3일 이전에 백신이 승인되기는 사실상 어렵다”며 “연말 또는 내년초 출시 후 원활한 공급은 2분기말에 가능하다”고 말했다. 존슨앤드존슨의 백신도 이르면 내년 초 출시될 것으로 예상했다.
박인혁 기자 hyuk@hankyung.com
관련뉴스














