
‘도네페질 패치제’는 알츠하이머병 신약만큼이나 시장의 주목도가 큰 약물이다. 하루에 한 번 이상 약을 복용해야 하는 데다, 질병의 특성상 환자들이 약물의 복용 여부를 자주 잊기 때문이다. ‘복약순응도’가 낮은 약물이다 보니 패치제에 대한 환자들의 수요가 크다.
3년 안에 도네페질 경구제의 30%를 대체하는 것이 목표
아이큐어는 개량신약 개발에 특화된 기업이다. 한 분야만 파고드는 최영권 대표의 ‘외골수’ 기질이 발휘된 덕이다.
최 대표는 서울대 약대에서 석사를, 미국 유타대에서 박사학위를 취득한 뒤 한국과학기술연구원(KIST)에서 연구원을 지냈다. 그 20여 년 동안 줄곧 약물전달시스템(DDS)을 연구했다. 그 결과, 아이큐어는 경구제나 주사제를 패치제로, 계열사인 아이큐어비앤피에서는 주사제를 경구제나 점막투약제로 전환하는 연구를 하고 있다. 최 대표는 “DDS에서 제형 연구는 큰 축”이라며 “환자나 의료진의 수요가 있으면서도 현실가능한 타깃을 찾는 게 가장 중요하다”고 말했다.
그가 찾은 최선의 타깃은 도네페질이었다. 도네페질, 갈란타민, 리바스티그민, 메만틴 등 FDA 승인을 받은 약물 중 가장 시장이 크다. 전문가들은 2024년 글로벌 시장의 도네페질 연간 매출 규모를 10조 원 이상으로 평가하고 있다.
패치제가 기존 경구제를 대체할 가능성도 높다. 2007년 노바티스가 개발한 리바스티그민 패치제는 10년도 채 되지 않아 경구제의 90% 이상을 대체했다. 최 대표는 “출시하고 3년 안에 경구제 시장의 30%를 대체하는 것이 목표”라고 말했다. 그의 계획대로라면 약 2조 원대 매출을 올리게 되는 셈이다. 이런 시장성을 보고 여러 기업이 도네페질 패치제 시장에 뛰어들었다. 국내에서는 동아에스티, 대웅제약, 보령제약 등이 도네페질 패치제 개발에 나섰고, 해외에서는 코리엄이 개발 중이다.
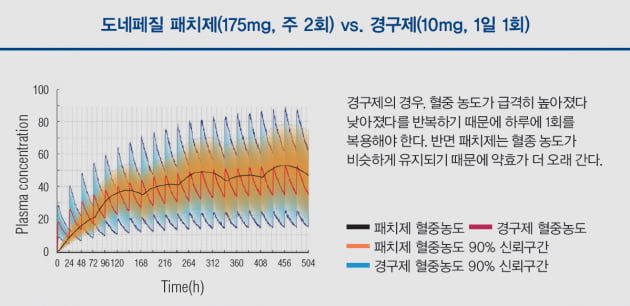
도네페질 패치제, 일주일에 2번만 투여해도 약효 지속돼
그중 아이큐어가 가장 빠른 속도를 낼 수 있었던 건 ‘나트릭스’ 플랫폼 때문이다. 이는 장기간 일정한 농도의 약물을 피하에 전달할 수 있는 기술이다.
패치제 표면에 대용량의 약물을 도포해야 확산의 원리로 약물이 피부 내부로 흡수될 수 있다. 이를 위해서는 용매 역할을 하는 점착제에 용해되는 도네페질의 양을 높이는 것이 관건이다. 패치제의 크기를 무한정 늘릴 수 없기 때문에 약물의 ‘집적기술’이 중요하다. 최 대표는 “여러 종류의 점착제 조합을 바꿔가며 최적의 배합을 찾았다”며 “도포된 도네페질 175ml당 10ml가 일정하게 들어간다”고 말했다.
실제 아이큐어의 패치제는 1일 투여량 10mg을 기준으로 너비가 50㎠ 정도다. 반면 미국의 바이오텍인 코리엄이 개발 중인 패치는 180㎠로 3.6배에 달한다. 180㎠면 웬만한 스마트폰 사이즈다.
아이큐어는 여기에 더해 피하 흡수량을 높이기 위해 피부의 상피조직을 느슨하게 만들어주는 물질을 첨가했다. 최 대표는 “주삿바늘이나 마이크로니들처럼 피부에 구멍을 뚫어 약물을 주입하는 침습적 방식이 아니기 때문에 추가적인 조치를 한 것”이라고 설명했다.
그럼 마이크로니들로 제작하는 것이 더 효과적이지 않을까. 최 대표는 “알츠하이머병 환자들에게는 한 번 붙이면 최소한 이틀 이상은 가는 패치가 필요하다”며 “오랫동안 일정한 약물을 주입하기 위해서는 비침습적 방식이 더 적합하다”고 말했다.
주사제(혹은 마이크로니들)나 경구제는 투여 즉시 약물의 혈중농도가 순간적으로 올라간다. 그러다 금세 농도가 떨어진다. 이 때문에 하루에 한 번 이상 투여를 해야 약물 효과를 지속시킬 수 있다. 최 대표는 “치료효과를 나타내는 중간 범위에 머물러 있는 시간이 매우 짧기 때문”이라며 “비침습적 패치제는 약물의 적정 농도를 꾸준히 유지할 수 있다는 장점이 있다”고 말했다. 아이큐어의 패치제는 일주일에 두 번만 투여하면 된다.
국내 출시는 올 연말께 가능할 것으로 보인다. 아이큐어는 2017년 셀트리온과 도네페질 패치제의 국내 공동 판권 계약을 체결했다. 셀트리온에서는 ‘도네리온패취’, 아이큐어는 ‘도네시브패취’라는 제품명으로 각각 판매할 예정이다.
해외 진출 계획도 갖고 있다. 현재 아이큐어 패치제는 미국 임상 1상을 목전에 두고 있다. 지난 4월 FDA의 임상시험계획(IND) 승인을 받고, 올해 하반기에는 환자 투약을 시작할 계획이다. 미국에서는 개량신약의 경우 1상에서 기존 약과 생물학적동등성이 입증되면 품목허가를 신청을 할 수 있다. 최 대표는 “2018년 완공된 완주공장의 cGMP(current Good Manufacturing Practice) 인증을 준비하고 있다”고 말했다.
cGMP는 FDA의 ‘우수의약품 제조품질관리기준’으로 까다롭기로 정평이 나 있다. cGMP 인증을 무사히 통과하면 이 공장에서 1년에 제작 가능한 11억 장의 패치제가 한국과 미국 등에서 판매가 이뤄진다.
최 대표는 “궁극적인 목표 시장은 미국이지만, 대만이나 말레이시아 등 일부 동남아시아 국가에서는 한국의 임상 데이터를 사용해 허가를 받을 수 있어 빠른 수출이 가능하다”며 “한국을 시작으로 여러 나라에 진출할 계획”이라고 말했다.
◎애널리스트 평가
<i>임상 1상, 무리 없이 진행될 것
by 허혜민 키움증권 책임연구위원 </i>
도네페질 패치제 국내 임상 3상을 성공적으로 마무리했다. 미국 FDA에 도네페질 패치제의 임상 1상을 신청했는데, 셀트리온과 국내 3상을 완수하며 경증 및 중등증 환자 대상 약품의 비열등성을 증명한 경험이 있기에 임상 진행에 큰 어려움이 없을 것으로 예상한다.
최지원 기자
관련뉴스













