유안타증권은 11일 휴젤에 대해 보툴리눔 톡신 제품의 식품의약품안전처의 품목허가 처분에 대한 위험요인(리스크)이 있다며 목표가를 25만원으로 낮췄다. 투자의견은 ‘매수’를 유지했다.
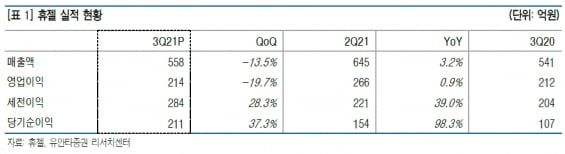
휴젤은 올 3분기에 매출 558억원과 영업이익 214억원을 기록했다. 전년 동기 대비 3.2%와 0.9% 늘었지만 시장 전망치(컨센서스)보다는 14.2%와 11.8% 밑돌았다.
국가출하승인 지연으로 인해 보툴리눔 톡신 국내 매출이 25.1% 줄어든 영향이란 분석이다. 국가출하승인은 보건위생상 특별한 주의를 요하는 백신, 혈액제제, 항독소 등의 국내 판매를 위해 국가에서 제품의 품질을 확인하는 제도다.
휴젤의 국내용 보툴리눔 톡신 제품에 대한 국가출하승인은 여전히 지연되고 있어 재고에 대한 여유가 부족하다는 분석이다. 이는 4분기에 일부 회복될 것으로 봤다.
4분기에는 식품의약품안전처의 품목허가 취소 처분에 대한 최종 결과가 중요할 것으로 봤다.
식약처는 전날 휴젤이 일부 보툴리눔 톡신 제품을 국가출하승인 없이 판매했다며 품목허가 취소 절차에 착수했다고 발표했다. 휴젤이 국가출하승인을 받지 않은 제품을 국내 도매 업체를 판매한 것을 문제 삼았다.
휴젤 행정처분 대상이 된 제품은 수출용으로 국가출하승인 대상이 아니라는 입장이다. 수출 허가를 받았으며 전량 수출됐다는 것이다.
이번 행정처분이 현재 진행 중인 보툴리눔 톡신 해외 허가에는 영향을 주지 않을 것으로 봤다. 휴젤은 보툴리눔 톡신에 대한 연내 유럽 승인을 기대하고 있다. 유럽의약품청(EMA)은 지난달 현장 실사를 완료했다. 미국 품목허가는 내년 상반기를 예상하고 있다.
서미화 연구원은 “국가출하승인을 받지 않은 제품이 국내에 설립된 유통망에 공급된 문제”라며 “안전성이나 품질 문제가 아니므로 해외 허가 절차에 영향을 미치지는 않을 것”이라고 말했다.
박인혁 기자
관련뉴스















