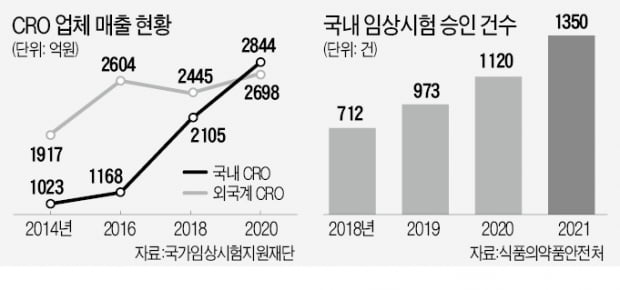
60조원 규모로 추산되는 세계 CRO 시장에서 국내 시장 규모는 100분의 1에 불과하다. 시장 규모가 큰 유럽, 미국 등에서 임상이 많이 이뤄지기 때문이다. 게다가 코카서스인(백인)을 대상으로 한 임상 데이터를 확보해야 미국 유럽 등에서 허가를 받을 수 있다. 국내 제약·바이오기업들이 유럽 미국 등에서 임상 경험이 풍부한 외국계 CRO를 선호해온 이유다.
최근 들어선 분위기가 달라지고 있다. 신약 임상의 초기 단계인 연구자 임상, 임상 1상에서도 국내 기업들의 계약 수주 사례가 늘고 있다. 국내 기업들의 경쟁력이 높아진 데다 미국 식품의약국(FDA) 등이 국내에서 진행한 임상 데이터를 인정해주는 사례가 늘고 있어서다. 국내 CRO 업체 관계자는 “국내 업체들의 임상 계약 단가가 5년 전엔 외국계 대비 30~40%에 불과했지만 최근엔 70% 수준까지 높아졌다”고 했다.
임상 규모가 갈수록 커지는 것도 국내 기업들엔 호재다. 식품의약품안전처에 따르면 2018년 712건이었던 국내 임상시험 승인 건수는 지난해 1350건으로 두 배 가까이 늘었다. 보건복지부가 약가 상한금액 재평가에 들어가면서 제약사들이 약가를 최대한 받기 위해 임상 입증 자료 확보에 공들이고 있는 영향을 받았다. 지난해 에이디엠코리아와 씨엔알리서치 등 국내 CRO 기업들이 줄줄이 상장하면서 공격적인 영업 전략을 펼친 점도 매출 확대에 영향을 미쳤다.
후기 임상 역량을 갖춰야 하는 건 숙제다. 임상 1상은 모집 환자 수가 적어 국내에서도 백인 대상 데이터를 확보할 수 있지만 수백 명 이상을 대상으로 하는 후기 임상부터는 백인 등 다인종을 대상으로 한 임상이 국내에선 사실상 불가능하다. 이 때문에 국내 시장에만 머물던 국내 기업들이 해외 진출에 나서고 있다. 씨엔알리서치는 연내 미국 진출을 추진 중이다. 씨엔알리서치 관계자는 “국내 제약·바이오 기업들의 미국 임상 1·2상을 대행해주는 게 목표”라고 했다.
이주현 기자 deep@hankyung.com
관련뉴스














