그랩바디T는 에이비엘바이오의 이중항체 플랫폼 중 하나다. 4-1BB를 활성화해 T세포의 항암면역 반응을 촉진한다. 위해주 연구원은 “그랩바디T 플랫폼이 적용된 임상 결과 공개는 처음”이라며 “플랫폼의 임상적 개념 검증을 미리보기할 수 있는 기회”라고 말했다.
그는 “로슈의 4-1BB 이중항체 논문과 경쟁사의 임상 결과는 1상에서 기대할 수 있는 효능 수준을 제시한다”며 “다만 1상의 목적은 안전성 확인, 최적 용량 선정, 반응 암종 관찰 등으로, 1상 결과로 성공 여부를 판단하기는 이르다”고 했다.
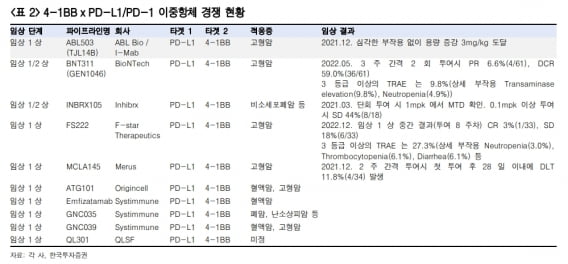
올 상반기 보고될 ABL503 중간결과에서는 부분관해(PR) 이상의 사례가 관찰될 것으로 전망했다. 안전성 우려는 낮을 것이라고 했다. 위 연구원은 “ABL503 유사 후보물질의 1·2상 중간결과에서 안전성 이슈는 크지 않았지만 객관적 반응률은 최대 6.6%로 낮았다”며 “에프스타테라퓨틱스의 임상에서는 완전관해 사례도 있었다는 것이 고무적”이라고 했다.
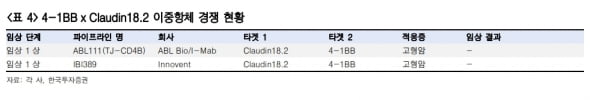
ABL111의 유사 파이프라인의 임상 결과 보고는 아직 없다고 했다. 하지만 ABL111과 동일한 종양항원 CLDN18.2를 표적하는 항체 ‘졸베툭시맙’의 1상 결과를 참고하면 넘어야 할 효능의 기준은 낮다고 판단했다.
졸베툭시맙은 최근 항암화학요법과 병용 시 CLDN18.2 양성 위식도접합부 환자의 무진행생존기간을 개선한다는 3상 결과를 발표했다. 하지만 1상에서 부분관해 사례는 한 명뿐이었다. 특성상 Claudin18.2 발현 환자에서만 반응을 보이는 기전 때문이다.
위 연구원은 “ABL111의 용량 증량 1상에서는 안전성 확인과 부분관해 환자가 나타나는 것만으로 약물의 임상적 개념을 입증할 만하다”며 “단 병용 전략을 마련하는 것이 필요할 것”이라고 했다.
김예나 기자 yena@hankyung.com
관련뉴스














