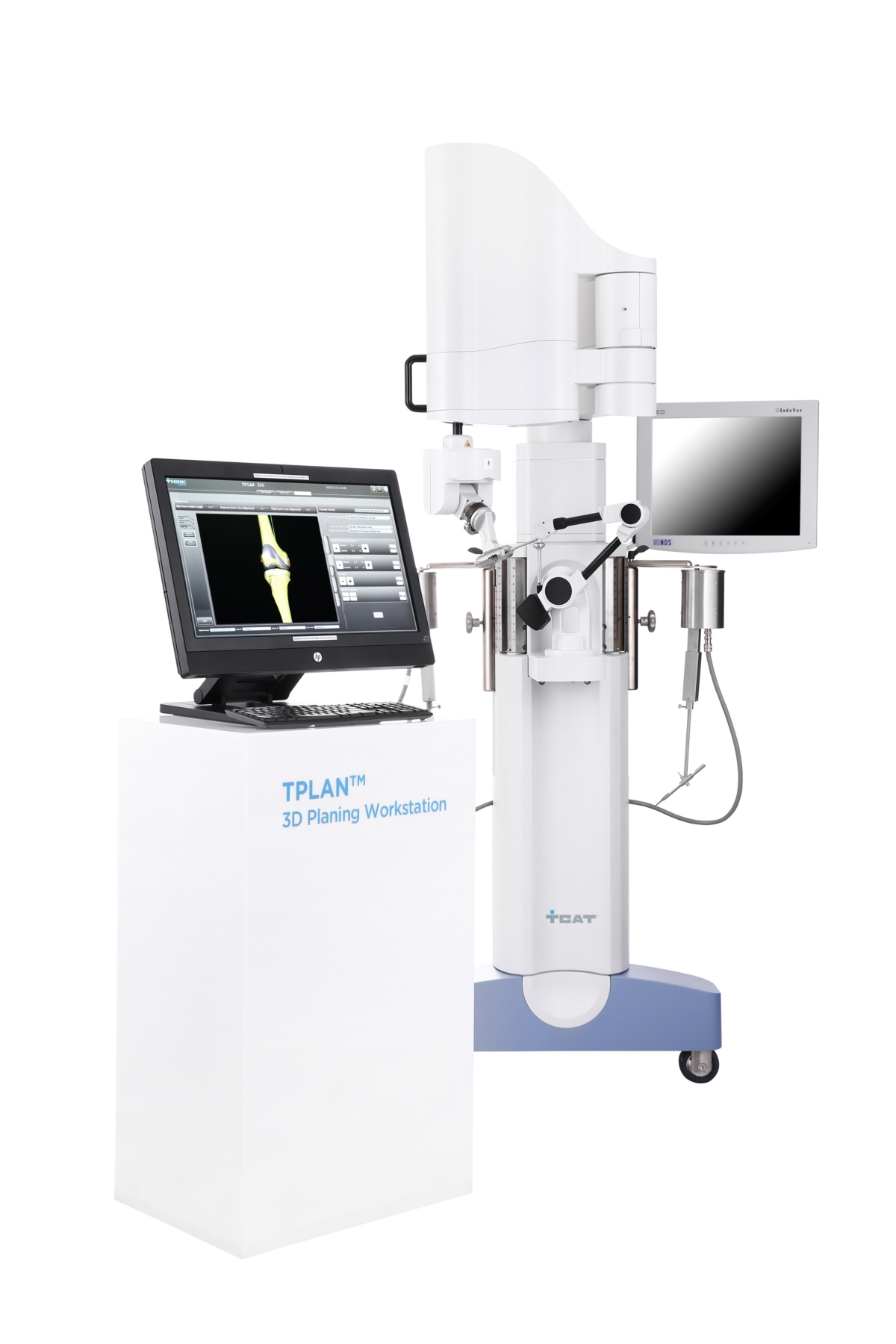
의료로봇 전문기업 큐렉소는 29일 투자회사 티에스아이(TSI, 美 프리먼트 소재)가 인공관절 수술로봇 티솔루션원의 슬관절 FDA(미국 식품의약국) 허가 신청을 완료했다고 밝혔습니다.
큐렉소는 "FDA 승인이 완료되면 미국, 유럽, 아시아 등 글로벌 지역의 중소형 인공관절 업체들과 협력할 수 있도록 판매방안을 모색 중"이라며 "티에스아이는 FDA 승인 신청과 동시에 CE(통합규격인증)마크를 보유하고 있는 티솔루션원의 유럽, 아시아태평양 판매를 위한 마케팅 활동도 진행하고 있다"고 설명했습니다.
큐렉소측은 이번 슬관절 FDA 승인이 완료되면 미국 시장의 판로가 열리면서 글로벌 수술로봇 시장에서의 확고한 위치와 성장이 가능할 것으로 기대했습니다.
보건산업진흥원에 따르면 2021년 전세계 인공관절시장은 181억달러(약21조5,000억원)로 예상되며, 이 가운데 미국이 61%로 압도적인 시장점유율을 보이고 있습니다.
이와 함께 큐렉소는 현재 세계 척추로봇시장 선점을 목표로 개발중인 수술로봇 `큐비스-스파인(CUVIS-spine)`은 안전성 확보를 위한 시험검사 중으로 연내 국내 인허가를 완료할 계획이라고 설명했습니다.
정형외과 수술로봇인 `큐비스-조인트(CUVIS-joint)`도 현재 시제품 완성단계로 올해 7월 시험검사에 예정돼 있다며 2020년 1분기 인허가 완료를 목표로 준비중이라고 회사측은 덧붙였습니다.
관련뉴스














