이번 프로그램은 씨엔알리서치의 20년 이상의 임상시험 약물감시 노하우를 IT시스템과 결합해 독자적으로 만들었다.
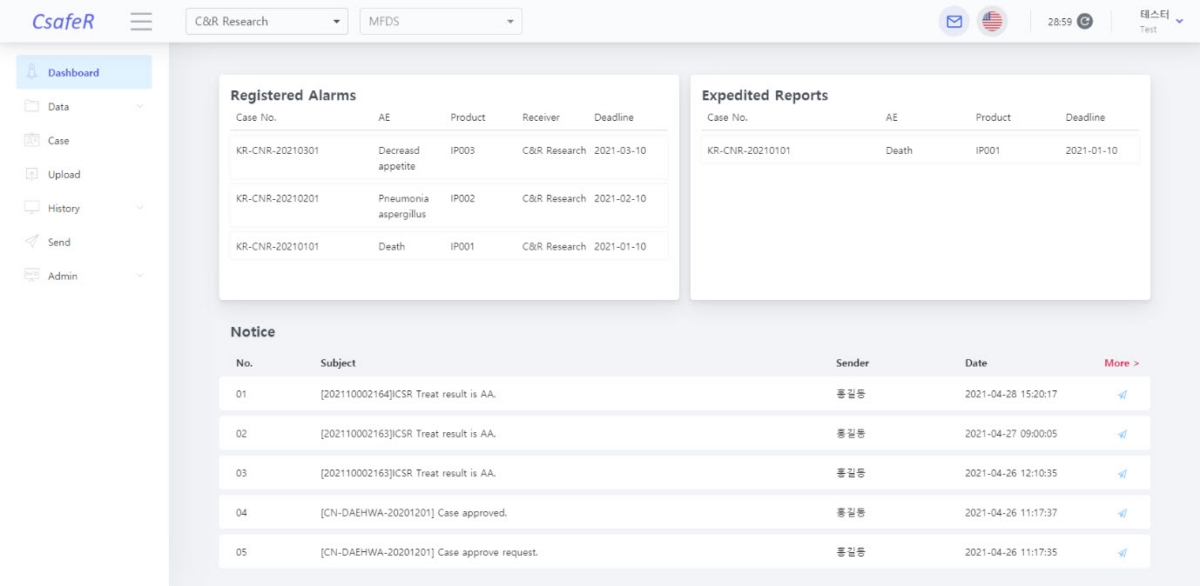
식품의약품안전처가 국제의약품규제조화위원회(ICH)에 가입함에 따라 오는 6월부터 국내의 약물이상반응 및 이상사례 보고 시 ICH가 정한 국제표준서식[E2B(R3)]의 적용이 의무화된다.
임상시험과 관련한 부작용 중 약물이상반응(SUSAR)은 식약처에 즉시 신속보고해야 할 의무 사항이며, 시판 후 중대한 약물이상반응(SADR) 및 기타(AE)는 일괄보고 항목에 해당한다.
씨엔알리서치의 씨세이퍼는 전자시스템을 통한 임상시험 보고서의 진행과 의학적 평가를 동시에 진행할 수 있으며, ICH 국제 가이드라인에 기반해 국내 식약처 맞춤형 보고서를 구축할 수 있다.
윤문태 씨엔알리서치 대표는 "국내 임상시험 수요가 폭발적으로 증가하면서, 임상 데이터의 국제 표준에 대한 국제적인 요구도 강해지는 추세"라며 "약물이상반응 보고를 위한 전자 시스템인 씨세이퍼를 통해 국내 임상 시스템이 글로벌 표준에 더 가까워지는 계기가 될 것"이라고 밝혔다.
관련뉴스














