미 존스 홉킨스 연구진, '패러다임 전환' 자평
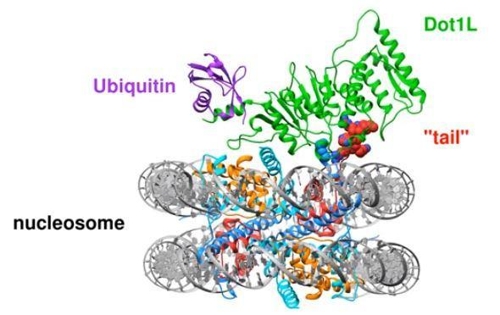
(서울=연합뉴스) 한기천 기자 = 뉴클레오솜은 염색체(Chromosome) 구성의 기본 단위다.
네 종류의 히스톤 분자로 이뤄진 코어(히스톤 8량 체)를 실 모양의 DNA가 감고 있는 구조다. 그런데 DNA의 유전자를 '온·오프' 하려면 반드시 뉴클레오솜이 특정 효소와 상호작용을 해야 한다.
소아 백혈병의 일종인 '혼합 계통 백혈병'은, 뉴클레오솜과 작용하는 효소 중 하나인 Dot1L의 돌연변이로 생긴다.
이 효소를 발현시키려면 먼저 유비퀴틴(ubiquitin)이라는 저분자 단백질을 꼬리표처럼 뉴클레오솜에 붙여야 한다. 그러나 Dot1L 효소가 뉴클레오솜이나 유비퀴틴 단백질과 어떻게 상호작용을 하는지는 지금까지 베일에 가려 있었다.
미국 존스 홉킨스대 의대 과학자들아 마침내 이 메커니즘의 작동 원리를 밝혀냈다. 이 대학의 신시아 월버거 생물물리학·화학 교수팀은 관련 연구보고서를 저널 '셀(Cell)'에 발표했다.
22일(현지시간) 온라인(www.eurekalert.org)에 공개된 연구 개요에 따르면 월버거 교수팀은 고해상도 영상을 얻기 위해 극저온 전자현미경(cryo-EM)을 사용했다.
이 첨단 기술 덕에 지금까지 한 번도 보고되지 않은 뉴클레오솜 코어(중심부)의 극적인 구조 변화를 생생히 관찰할 수 있었다. 놀랍게도 Dot1L은 뉴클레오솜과 더 단단히 결합하기 위해 뉴클레오솜의 구조 자체를 바꿨다.
Dot1L이 연결되자 뉴클레오솜의 코어에서 꼬리 모양의 돌기가 나와, Dot1L을 자기 표면에 고정했고, 곧이어 뉴클레오솜의 다른 구조 변화가 꼬리를 물고 일어났다.
이 발견은 유전병에 대한 기존 관념을 바꾸는 '패러다임 전환(paradigm shift)'이 될 수 있다고 연구팀은 자평한다. 특히 소아 백혈병의 새로운 치료법 개발로 이어질 것이라는 기대가 크다.
월버거 교수의 실험실 동료인 이반 워든 박사후과정 연구원은 "지금까지 존재 자체를 몰랐던 발견의 문을 활짝 연 것과 마찬가지"라고 말했다.
이번 연구의 다른 중요한 부분은, 바로 옆 실험실의 제임스 버거 교수팀이 맡았다. 연구의 초점은, DnaC라는 효소가 어떻게 헬리카제(helicase; 나선효소)를 DNA와 연결하는지에 맞춰졌다.
박테리아를 관찰 실험한 결과, DnaC가 헬리카제와 결합해 헬리카제의 '고리(ring)'를 자극하면, 이 고리가 DNA 가닥 표면에 틈을 만들어 달라붙는다는 걸 발견했다.
헬리카제가 DNA '복제 기계'의 모터라면, 헬리카제에 동력을 공급하는 6개의 고리는 실린더와 비슷하다. DNA 복제에 앞서 이중나선이 풀릴 때 이들 고리는 각각의 가닥을 휘감고 함께 움직인다.
이번 연구를 계기로, 헬리카제를 표적으로 하는 새로운 항균 치료법이 개발될 가능성이 커졌다. 아울러 헬리카제가 돌연변이로 오작동할 때 어떻게 유전질환을 일으킬 수 있는지도 더 잘 이해하게 될 것으로 기대된다.
cheon@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














