"부풀리기 홍보 안 하면 주주들 항의 시달려" 해명
(서울=연합뉴스) 계승현 기자 = 신종 코로나바이러스 감염증(코로나19) 유행 이후 제약·바이오 업체의 '코로나19 상술' 경쟁이 끊이지 않자 국민에게 헛된 희망을 심어주고 있다는 비판이 나온다.
1일 제약바이오업계에 따르면 업체들은 코로나19 신약 개발이나 약물 재창출 연구와 관련된 자료를 쏟아내며 포털의 실시간 검색어와 뉴스토픽에 회사의 이름을 올리는 데 혈안이 돼 있다.
포털에 이름이 올라가면 주가가 급등하는 현상을 노리는 것이다.
이에 제약사들은 전임상 단계인 동물실험이나 시험관 내 세포 실험(인 비트로) 중간결과까지 앞다퉈 발표한다. 급기야 의약품 사용 승인이 미뤄졌지만, 자체 성능 평가는 훌륭했다는 자기변명 식의 자료까지 나온다.
그러나 이렇게 홍보에 열을 올리는 제약바이오기업 중에는 임상시험 허가도 받지 않은 회사가 훨씬 많다.
현재 국내에서 진행 중인 코로나19 의약품 임상은 13건(치료제 11건, 백신 2건)이다.
치료제 11건 임상은 대부분 연구자 임상이나 임상 2상 단계다. 연구자 임상은 안전성과 유효성이 검증되지 않은 약이나 시판 중인 약으로 수행하는 연구 목적의 임상을 말한다. 국내 개발 백신은 1/2a상으로 안전성, 내약성, 면역원성을 평가하고 있다.

실제로 의약품 개발 과정은 멀고도 험난하다.
전임상 시험에서 동물에 테스트한 뒤 통과하면 사람을 대상으로 1상을 진행하는데, 안전성 검증을 최우선으로 두는 경우가 많다. 본격적으로 약의 효능을 알아보는 단계는 임상 2상이며, 평균적으로 1∼2년이 걸린다. 효능이 어느 정도 입증된 약을 대상으로 마지막 검증하는 단계는 임상 3상인데, 평균적으로 3∼5년이 소요되며, 이 과정을 통과해야만 신약 허가를 해달라고 식품의약품안전처에 신청할 수 있다.
한국제약바이오협회의 말을 들어보면 의약품 후보물질이 임상 1상을 통과해 신약 허가승인에 도달하는 비율은 평균 9.6%에 불과하다. 임상 3상에 착수해도 신약 허가 신청으로 이어지는 비율이 60%도 되지 않는다.
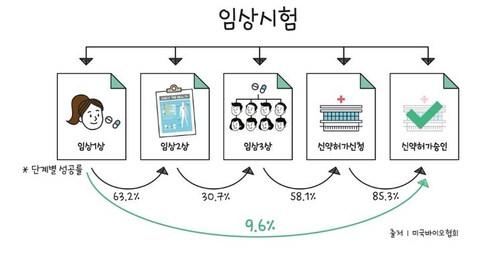
제약바이오 기업들의 신약개발 성과 홍보가 실제 코로나19 의약품 개발의 국내 현황과 괴리가 있다는 지적이 나오는 까닭이다.
한 제약업계 관계자는 "초기 실험 성공 자료만 내도 주가가 급등하다 보니 자잘한 중간결과 발표도 놓칠 수 없다"며 "테마주가 유행하는 국내 주식시장의 특성 때문에 의미 없는 성과라도 코로나19를 끼워 넣은 부풀린 홍보를 하게 된다"고 말했다.
이 관계자는 "정말 의미 있는 임상 허가 및 자료만 내는 기업의 경우 '왜 홍보를 게을리하냐'는 주주들의 항의에 전화기가 조용한 날이 없다"고 밝혔다.
김우주 고대구로병원 감염내과 교수는 "같은 코로나바이러스인 사스, 메르스 유행 당시 치료제 및 백신 개발에 도전하지 않았던 업체들이 하루아침에 코로나19 신약을 만들어낼 수는 없다"고 꼬집었다.
김 교수는 "제약사들의 발표가 국민에게 희망을 주는 건 맞지만, 평균적으로 15년 이상 걸리는 치료제나 백신이 그 희망만으로 만들어지는 건 아니다"라고 지적했다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














