[ 조미현 기자 ] 삼성바이오에피스가 개발한 바이오시밀러(항체의약품 복제약) ‘플릭사비’가 유럽에서 판매허가를 받았다. 삼성바이오에피스의 바이오시밀러가 유럽 승인을 받기는 지난 1월 ‘베네팔리’에 이어 두 번째다. ▶본지 4월4일자 A1, 17면 참조
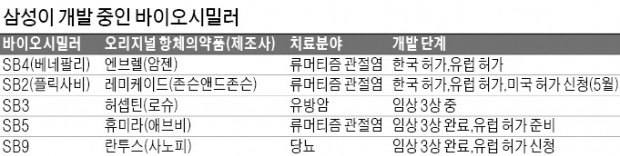
삼성바이오에피스는 유럽연합(EU) 집행위원회가 플릭사비의 판매를 최종적으로 허가했다고 30일 발표했다. 지난달 초 유럽의약국(EMA)의 약물사용자문위원회에서 긍정적인 의견을 받은 뒤 두 달 만에 판매 승인이 떨어진 것이다. 플릭사비는 글로벌 제약사인 존슨앤드존슨의 항체의약품 레미케이드를 복제한 의약품으로 류머티즘 관절염, 궤양성 대장염, 크론병, 건선 등에 효과가 있다. 레미케이드는 세계에서 한 해 9조원가량 팔리는 초대형 의약품이다.
삼성바이오에피스는 EU 회원국 28개 국가와 노르웨이 아이슬란드 리히텐슈타인 등 유럽 경제공동체 3개국 등 총 31개국에서 플릭사비를 판매할 수 있게 됐다. 유럽 판매는 미국 바이오 회사인 바이오젠이 맡는다.
삼성바이오에피스는 플릭사비와 원조 의약품 레미케이드의 효능 동등성 및 안전성을 확인하기 위해 세계 11개국에서 584명을 대상으로 임상시험을 했다. 54주 동안 이뤄진 임상시험 결과는 지난해 미국류머티즘학회에서 발표됐다. 지난 24일에는 미국 식품의약국(FDA)에 판매허가 신청서를 제출했다. 국내에서는 지난해 12월 렌플렉시스란 이름으로 허가를 받았다. 플릭사비는 셀트리온이 세계 최초로 개발한 바이오시밀러 ‘램시마’와 비슷한 제품이다. 램시마는 올해 1분기 기준 누적 처방환자 수가 8만2000명을 넘어서면서 유럽에서 레미케이드 시장의 30%가량을 잠식한 것으로 추정된다.
삼성바이오에피스는 지난 1월 류머티즘 관절염 치료제 엔브렐(제조사 암젠)의 바이오시밀러 베네팔리를 유럽에 선보인 뒤 빠른 속도로 후속 제품을 내놓고 있다. 올 하반기에는 휴미라 바이오시밀러에 대해 유럽에 판매허가를 신청할 계획이다.
삼성바이오에피스 관계자는 “유럽에서 허가 심사를 하는 데만 통상 14~16개월이 걸린다”며 “두 제품은 내년께 판매가 가시화될 것으로 기대한다”고 말했다.
조미현 기자 mwise@hankyung.com
50% 이상 상승할 新유망주 + 급등주 비밀패턴 공개 /3일 무료체험/ 지금 확인
매일 200여건 씩 업데이트!! 국내 증권사의 리서치 보고서 총집합! 기업분석,산업분석,시장분석리포트 한 번에!!
한경스타워즈 실전투자대회를 통해서 다양한 투자의견과 투자종목에 대한 컨설팅도 받으세요
[한경닷컴 바로가기] [스내커] [한경+ 구독신청] ⓒ '성공을 부르는 습관' 한경닷컴, 무단 전재 및 재배포 금지
관련뉴스














