유럽 약물사용자문위 '긍정 의견'…내년 10월께 시중에서 팔릴 듯
설립 5년 된 후발주자지만 속도전으로 시장 승기 잡아
6개 신약후보물질 확보 '급성장'
[ 김근희 기자 ] 삼성바이오에피스가 류머티즘관절염 치료제 바이오시밀러(항체의약품 복제약) ‘임랄디’(프로젝트명 SB5)의 유럽 판매 허가를 사실상 획득했다. 유럽에서 판매 중인 베네팔리, 플릭사비에 이은 세 번째 성과다. 세계 바이오시밀러 개발 업체 중 항체의약품 바이오시밀러 제품 3개를 허가받은 곳은 삼성바이오에피스가 유일하다. 설립 5년 만에 선발업체 셀트리온과 다국적제약사 산도즈 등을 추월하면서 바이오시밀러 시장의 선도자(퍼스트 무버)가 됐다는 평가가 나온다. 고한승 삼성바이오에피스 사장(사진)은 “특유의 속도전과 기술력의 성과”라고 말했다.
◆폭풍 질주하는 삼성바이오에피스
삼성바이오에피스는 지난 23일 유럽의약품청(EMA) 약물사용자문위원회(CHMP)로부터 류머티즘관절염 치료제인 임랄디 판매 허가에 대해 ‘긍정 의견’을 받았다.
임랄디의 원조의약품은 미국 제약사 애브비의 류머티즘관절염 치료제 ‘휴미라’다. 지난해에만 매출 18조원을 올린 세계 판매 1위 바이오 의약품이다. 일반적으로 CHMP에서 긍정의견을 받으면 2~3개월 안에 최종 판매 허가가 나온다. 제품 판매는 휴미라의 물질특허가 만료되는 내년 10월 이후가 될 것으로 보인다. 휴미라 바이오시밀러로 유럽 허가를 받는 것은 암젠의 ‘암제비타’에 이어 두 번째다.
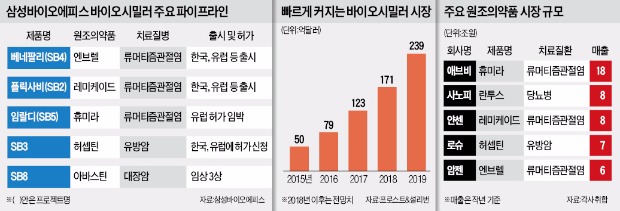
삼성바이오에피스는 세계 최초로 3개의 바이오시밀러 판매 허가를 받는 제약사가 된다. 이 회사는 류머티즘관절염 치료 바이오시밀러인 ‘베네팔리’와 ‘플릭사비’를 이미 유럽에서 판매 중이다. 경쟁회사 산도즈와 셀트리온이 허가받은 바이오시밀러는 각각 2개뿐이다. 2012년 설립된 삼성바이오에피스는 후발주자인데도 6개 파이프라인을 확보했다.
◆동시다발 전략 통했다
이번 성과는 ‘동시다발 전략’이 빛을 발한 것이라는 분석이 나온다. 삼성바이오에피스는 설립 초기부터 세계에서 가장 많이 팔리는 바이오 의약품을 동시에 개발하는 전략을 폈다. 경쟁사처럼 순차적으로 바이오 의약품을 개발해서는 시장을 선점할 수 없다는 판단에서였다. 덕분에 연구개발(R&D)을 시작한 지 4년 만인 지난해 1월 유럽에서 베네팔리 판매 허가를 받았고, 4개월 뒤엔 두 번째 제품인 플릭사비도 판매 허가를 획득했다. 이 회사는 올해 안에 네 번째 바이오시밀러 판매허가도 기대하고 있다. 현재 EMA가 이 회사의 유방암 치료제 바이오시밀러 ‘SB3’의 판매 허가 절차를 밟고 있다.
프로세스 혁신도 한몫했다. 이 회사는 단기간에 바이오시밀러 판매 허가를 받기 위해 초기부터 허가에 걸리는 시간을 단축할 수 있는 전략을 폈다. 임상시험은 미국과 유럽 허가당국의 기준을 동시에 충족하도록 설계했다. 판매승인을 신청하면서 동시에 예상되는 추가 자료와 답변을 미리 준비해 시간을 단축했다.
고 사장은 “통상 1년6개월 이상 걸리는 제품 판매 승인 기간을 4~5개월 당겼다”고 설명했다.
◆세계 바이오시밀러 시장 한국 주도
세계 바이오시밀러 시장 전망은 밝다. 시장 규모가 2015년 50억달러에서 2019년 239억달러로 커질 전망이다. 미국 유럽 등 선진국이 보험재정 부담을 줄이기 위해 바이오시밀러 확대정책을 펴고 있어서다. 시장이 커지자 암젠, 화이자 등 다국적 제약사들도 바이오시밀러 개발에 뛰어들고 있다.
바이오시밀러 선두주자는 삼성바이오에피스와 셀트리온 등 한국 기업이다. 삼성바이오에피스가 개발과 허가에 속도를 내고 있고 셀트리온은 유럽과 미국에서 성과를 내고 있다. 지난해 셀트리온의 램시마는 유럽에서 40%의 시장 점유율을 기록했다.
주광수 한국바이오의약품협회 대표는 “한국 기업들이 바이오시밀러 시장 주도권을 더 강화할 수 있도록 해외 임상시험 지원 등의 대책이 필요하다”고 했다.
김근희 기자 tkfcka7@hankyung.com
기업의 환율관리 필수 아이템! 실시간 환율/금융서비스 한경Money
[ 무료 카카오톡 채팅방 ] 국내 최초, 카톡방 신청자수 30만명 돌파 < 업계 최대 카톡방 > --> 카톡방 입장하기!!
관련뉴스














