전문가들로 멘토링 조직 구성…허가 도우미·통합정보 뱅크 등
기업맞춤형 지원, 개발 활성화…AI의료기기 등 5건 허가받아
제품화 성공률 30%로 높이고 시장진입 2년 줄이는게 목표
[ 임유 기자 ]

미국 식품의약국(FDA)은 지난 4월 당뇨병성 안질환을 진단하는 아이디엑스의 인공지능(AI) 소프트웨어를 의료기기로 승인했다. 의사 없이 질환을 진단하는 AI 소프트웨어로는 세계 최초다. 불과 한 달 뒤 한국에서도 AI 의료기기가 허가됐다. 엑스레이로 골 연령을 판독하는 뷰노의 진단 보조 소프트웨어다. 8월엔 JLK인스펙션과 루닛의 제품이 나란히 AI 의료기기로 승인받았다. 의료 분야에 AI, 가상현실(VR), 첨단 정보기술(IT)이 접목될 수 있도록 식품의약품안전처가 발 빠르게 가이드라인을 마련한 덕분이었다. 김동민 JLK인스펙션 이사는 “식약처가 2016년 12월 AI 의료기기 가이드라인을 내놓고 인허가 과정에서 멘토링을 해준 것이 큰 도움이 됐다”며 “시행착오를 줄인 것은 물론 기술을 상업화하는 데 많은 공부가 됐다”고 했다.
“제품화 성공률 6배 높일 것”
식약처는 2016년 5월 혁신 의료기기의 조기 시장 진입을 앞당기는 ‘차세대 의료기기 100 프로젝트’를 시작했다. 임상, 의약품제조품질관리기준(GMP), 허가 등 제품 개발 전 주기에 걸쳐 맞춤형 멘토링을 제공한다. 국내 의료기기회사가 연구개발부터 제품화까지 걸리는 시간이 평균 15년으로 미국(8년) 유럽(10년) 일본(11년) 등에 비해 늦다는 문제의식에서다. 이를 위해 민관 합동으로 ‘헬스케어 활성화 추진단’을 꾸렸다. 추진단은 지금까지 세계 시장을 선점할 만한 혁신 제품 69개를 선정했다. 이들 기업은 연구개발부터 허가 절차에 이르기까지 전문가들의 멘토링을 받는다. 기업, 대학, 병원, 정부 등 350여 개 기관이 추천한 전문가와 식약처 산하 의료기기위원회 위원 65명 등 219명이 멘토다. 식약처 관계자는 “매년 20개, 5년간 100개를 선정해 지원할 계획”이라며 “정부가 지원하는 R&D 과제의 제품화 성공률을 5%에서 30%로 끌어올리고 신제품의 시장 진입 기간을 2년 줄이는 게 목표”라고 했다.
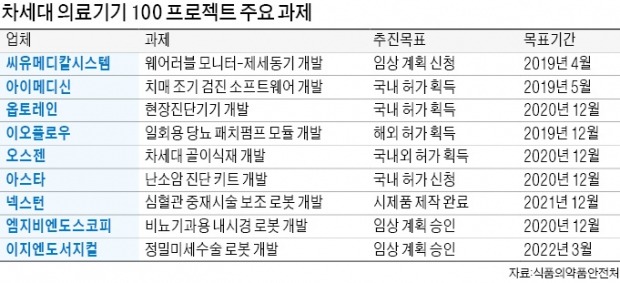
R&D부터 제품화까지 지원
지금까지 69개 선정 기업에 현장 278건, 서면 132건 등 410건의 지원이 이뤄졌다. 이 덕분에 32건이 FDA의 의약품품질관리(cGMP) 심사 통과, 임상시험 계획 승인 등의 성과를 올렸다. 이오플로우의 체외용 인슐린 주입기, JLK인스펙션의 AI 의료기기 등 5건은 식약처 허가를 받는 데 성공했다. 식약처 관계자는 “멘토링 지원으로 기업들의 개발 비용 2억8700만원을 절감하고 소요 기간은 37개월을 단축했다”고 했다.
식약처는 AI, 3차원(3D) 프린팅, 수술로봇 등 첨단 의료기기 개발 지원에 힘을 싣고 있다. 업계 관계자는 “AI, VR 등에 관한 가이드라인은 한국이 미국, 유럽보다 빨리 나왔다”며 “식약처가 선제 조치에 나서고 있는 것은 고무적”이라고 했다.
식약처는 허가 준비 과정에서 도움을 주는 ‘허가 도우미 제도’, 국내외 규제 동향과 복잡한 인허가 절차 등에 대한 정보를 제공하는 ‘의료기기 통합정보 뱅크’ 등의 지원도 하고 있다. 국내 최초 수술로봇인 레보아이도 이런 지원을 받아 3월 출시됐다. 류영진 식약처장은 “국산 의료기기 개발 촉진과 신속한 제품화를 위해 기술 정보, 행정 절차 등의 지원을 계속할 것”이라며 “기업 맞춤형 지원을 통해 첨단 의료기기 개발을 활성화하겠다”고 했다.
임유 기자 freeu@hankyung.com
관련뉴스














