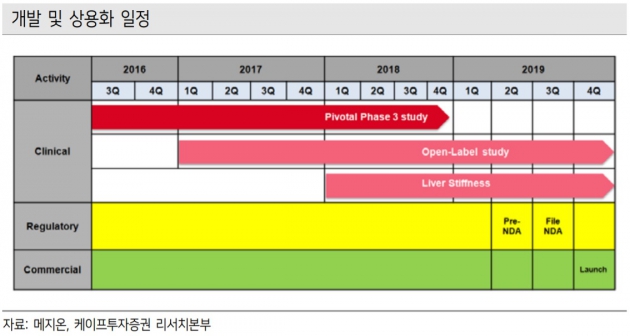
김형수 연구원은 "메지온은 미국에서 폰탄수술환자 치료제를 개발 중"이라며 "현재 임상 3상을 끝내고 이달 말 결과 발표가 예상된다"고 말했다. FDA와 다음달 판매허가 신청을 위한 사전회의를 실시하고 올 3분기에 허가를 신청할 예정이다. 이 경우 내년 상반기 출시가 가능할 것으로 봤다.
판매허가 승인 시에는 우선심사권(PRV) 수여로 추가 수익도 발생할 것으로 기대했다. FDA는 희귀소아질환이나 풍토병 치료제 개발을 유도하기 위해 PRV를 개발사에 부여하고 있다. 신약허가 신청 시 PRV를 같이 제출하면 통상 10개월이 걸리는 심사기간을 6개월로 단축해준다.
김 연구원은 "PRV는 평균 1억4000만달러(약 1580억원)에 다국적 제약사들간에 거래 중"이라며 "메지온의 추가 수익원으로 활용될 것"이라고 전망했다.
한민수 한경닷컴 기자 hms@hankyung.com
관련뉴스















