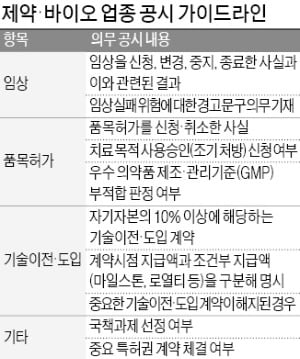
 금융위원회는 9일 이 같은 내용의 ‘제약·바이오 업종 기업을 위한 포괄공시 가이드라인’을 발표하고 즉각 시행하기로 했다. 지금까지 투자 심리에 부정적 영향을 미치는 공시는 하지 않는 경우가 많았는데 이런 관행에 제동을 걸겠다는 것이다.
금융위원회는 9일 이 같은 내용의 ‘제약·바이오 업종 기업을 위한 포괄공시 가이드라인’을 발표하고 즉각 시행하기로 했다. 지금까지 투자 심리에 부정적 영향을 미치는 공시는 하지 않는 경우가 많았는데 이런 관행에 제동을 걸겠다는 것이다.우선 임상 관련 공시를 대폭 강화했다. 임상시험 계획 신청 단계부터 중지, 변경, 종료 및 결과 등을 구체적으로 공시해야 한다. 투자자들이 임상시험 진행 현황을 정확하게 파악할 수 있도록 하기 위해서다. 특히 임상 결과에 대한 공시가 대폭 강화된다. 임상시험 톱라인 데이터를 제출받거나 해당 내용을 임상 관련 학회, 학술지 등을 통해 발표하는 경우 해당 내용을 공시해야 한다. 1차 평가지표(주평가지표)의 통계적 유의성(statistically significant) 여부 등도 객관적으로 공시해야 한다. 금융위 관계자는 “신약 개발의 성패는 임상시험 결과 등을 토대로 규제기관이 시판을 허가하는지 여부에 따라 결정되는 것”이라며 “중간단계인 임상시험 결과를 ‘임상시험 성공’으로 공시하는 일은 사라질 것”이라고 말했다.
임상 뒤 의약품 품목허가 절차와 관련해서도 신청 사실과 그 결과, 허가취소 처분, 품목허가 전 사용 신청 사실 등이 의무 공시 내용에 포함됐다.
투자심리에 영향을 줄 수 있지만 실질적으로는 중요하지 않은 내용을 공시하는 것을 금지했다. ‘임상 첫 환자 등록’ ‘의약품 규제당국과 면담 예정’ 등이 대표적이다. 오해를 낳을 우려가 있는 표현도 사용할 수 없다. 예컨대 규제당국이 임상 3상 개시를 승인했을 경우 ‘임상 3상 승인’이 아니라 ‘임상 3상 계획 승인’으로 써야 한다. 임상 관련 공시를 할 때 투자자가 관련 위험(리스크)을 충분히 인지할 수 있도록 경고 문구를 넣는 것도 의무화됐다. 새 신약 개발을 시작했다는 등 임상 관련 공시를 할 때 ‘개발에 실패할 수 있다’는 주의 문구를 넣는 식이다.
양병훈 기자 hun@hankyung.com
관련뉴스















