
화학공장은 전처리, 반응, 분리·정제 영역으로 나눌 수 있다. 주요 구성 장치는 반응기, 열교환기, 분리기(증류탑, 흡착탑)가 있다. 증류탑과 흡착탑은 불순물을 제거하거나 생성물의 순도를 높이는 역할을 하며, 열교환기는 온도가 다른 유체가 흐르는 관을 접촉해 에너지 비용을 절감시켜준다. 우리나라에 분리·정제 및 열교환기에 대한 세계적인 전문가들이 많지만 반응기를 설계할 수 있는 전문가는 매우 드물다. 그 이유에 대해 알아보자.
대부분 촉매는 반응속도를 증가시켜 주는 역할을 하며, 화학과와 화학공학과에서 다루는 촉매의 종류는 다르다. 화학과에서는 반응물과 촉매의 상(phase: 물질의 상태)이 같은 균일(homogeneous) 촉매를 다룬다. 즉 반응물과 촉매가 모두 액체기 때문에 반응물이 촉매에 접촉하는 현상을 크게 고려하지 않는다. 화학공학과에서는 반응 이후 반응물과 촉매를 쉽게 분리하기 위해 반응물과 촉매 간 상이 다른 불균일(heterogeneous) 촉매를 사용한다. 일반적으로 반응물의 상은 액체, 기체 또는 액체/기체며 촉매는 주로 고체를 사용한다.
반응물이 촉매 활성점에 도달하는 과정(확산, 흡착)과 촉매 표면반응 중 더 느린 과정이 ‘속도 결정단계’며, 이는 전체 반응시간을 결정한다. 대전 유성구에 있는 한국에너지기술연구원에서 부산역을 간다고 가정하면, 연구원에서 대전역까지 택시로 20분이며 부산역까지는 KTX로 2시간이 걸린다. 여기서 속도 결정단계는 KTX 타고 가는 과정이며 전체 시간은 KTX 시간에 의해 결정되는 것이다. 표면 반응속도가 속도 결정단계일 때 온도가 10℃ 증가할 때마다 반응속도가 2배 증가한다는 경험법칙이 있다(사실 특정 활성화 에너지와 온도에서만 성립). 만약 물질전달이 속도 결정단계일 경우 100℃를 증가시켜도 전체 반응속도는 고작 1.7% 정도만 증가할 수 있다. 어느 과정이 속도 결정단계인지 정확히 파악하고, 그 속도를 증가시킬 수 있는 변수를 적절히 조절해야 한다.
반응이 일어남에 따라 열이 흡수(흡열반응)되거나 발생(발열반응)하기도 한다. 식물은 물과 이산화탄소를 결합해 포도당과 산소를 만드는 광합성 반응을 하며 이 반응은 대표적인 흡열반응 중 하나다. 화학평형 측면에서 흡열반응은 열이 충분히 공급돼야 반응이 더 많이 일어날 수 있으며, 발열반응의 경우 열을 잘 제거해줘야 반응이 더 많이 일어난다. 열을 어떻게 공급 혹은 제거할 것인가는 반응기를 어떤 형태로 제작할 것인가에 영향을 준다. 그리고 심한 발열반응의 경우 안전을 위해 온도 제어가 필수적이다. 반응기를 설계하기 위해서 반응공학, 촉매공학, 유체역학, 물질전달, 열역학, 설계 기술 등 다양한 학문이 요구되며 검증을 위해선 실제 반응기와 비슷한 대규모 실험 장치가 필요하다.
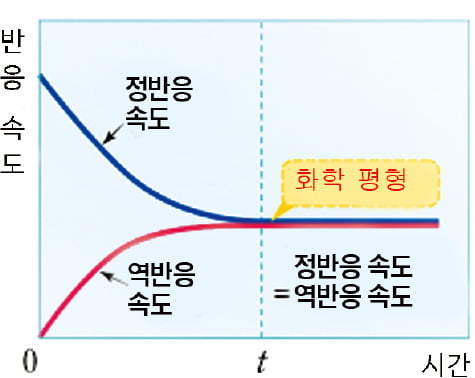
 화학반응은 어떠한 물질이 화학 변화를 겪어 다른 물질로 변화하는 과정이다. 반응속도는 어떤 화학 반응이 일어나는 속도이고 화학평형은 정반응 속도와 역반응 속도가 같아져 겉보기에 화학 반응이 일어나지 않는 것처럼 보이는 상태를 의미한다. 화학공장의 핵심 장치인 반응기를 설계하는 우리나라의 기술은 아직 미흡한 실정이다.
화학반응은 어떠한 물질이 화학 변화를 겪어 다른 물질로 변화하는 과정이다. 반응속도는 어떤 화학 반응이 일어나는 속도이고 화학평형은 정반응 속도와 역반응 속도가 같아져 겉보기에 화학 반응이 일어나지 않는 것처럼 보이는 상태를 의미한다. 화학공장의 핵심 장치인 반응기를 설계하는 우리나라의 기술은 아직 미흡한 실정이다.관련뉴스














