김상표 연구원은 “다른 NK세포 플랫폼 회사는 NK세포를 투여하기 위해 림프구 제거 화학 요법을 시행한다”며 엔케이맥스는 이 단계가 필요하지 않아 환자의 안전성이 크게 확보된다”고 말했다.
김 연구원은 “NK세포치료제 개발사인 페이트 테라퓨틱스 임상 결과 사이토카인방출증후군(CRS) 등 부작용과 암 재발 사례가 발생했다”며 “엔케이맥스의 NK세포치료제는 부작용이 없는 세계 첫 NK세포치료제로 상업화 될 가능성이 있다”고 했다.
고형암 치료 가능성도 긍정적으로 봤다. 엔케이맥스는 지난 8월 MSD·화이자와 공동으로 진행하는 불응성 고형암 환자 대상 임상 중간 결과를 공개했다. 기존 약물로 치료가 불가능한 수준의 육종암 말기 암환자 13명에 대한 우선 분석 결과다. 이중 8명이 치료효과를 보여 질병통제율(DCR) 61.5%, 완전관해(CR) 1명을 기록했다. 최종 결과는 내년 1분기 발표될 예정이다.
김 연구원은 “이는 NK세포치료제 최초로 고형암 말기 환자에게서 CR이 나온 것으로 주목할 만한 결과”라며 “공동임상을 진행한 글로벌 대형제약사(빅파마) 관련 기술 수출 및 투자 가능성이 커졌다”고 평가했다.
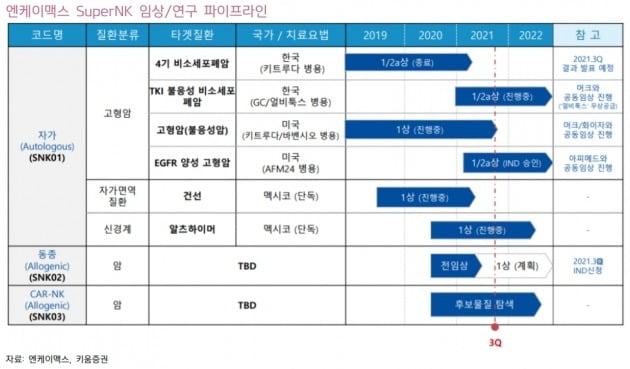
회사의 4기 비소세포폐암 환자 대상 임상 1·2a상 최종 결과도 우수할 것으로 예상했다. 엔케이맥스는 지난해 미국임상종양학회(ASCO)에서 중간 결과를 발표했다. 객관적반응률(ORR)은 44.4%였다. 키트루다 단독 투여 대비 5배 이상의 치료효과와 키트루다 병용 시 부작용을 감소시키는 효과를 나타냈다. 최종 결과는 내달 10일 열리는 미국 면역항암학회(SITC)에서 발표할 예정이다.
김 연구원은 “중간 결과와 유사한 수준의 최종 결과가 예상된다”며 “그렇게 되면 현재 진행 중인 미국 임상의 확장 코호트를 통해 별도의 임상시험계획(IND) 제출 없이 다양한 암종으로의 미국 임상 확대가 가능할 것”이라고 했다.
그는 “회사는 현재 삼중음성유방암(TNBC) 췌장암 전립선암에 대한 임상을 계획 중”이라며 “IND 없이 임상이 가능하므로 1~2년의 시간을 단축시킬 수 있다는 점에서 경쟁사 대비 빠른 임상 결과를 보일 것”이라 전망했다.
동종 NK세포치료제(SNK02) 개발도 본격화됐다고 봤다. 김 연구원은 “연내 SNK02 식품의약품안전처 1상 IND 신청 및 임상 개시가 목표”라며 “이를 통해 동종 NK세포치료제로의 확장 개발이 본격화될 것”이라고 말했다.
이도희 기자
관련뉴스














