메디톡스의 계열사 메디톡스코리아가 차세대 보툴리눔 톡신 제제 'MBA-P01'의 국내 임상 3상 피험자 모집을 완료했다.
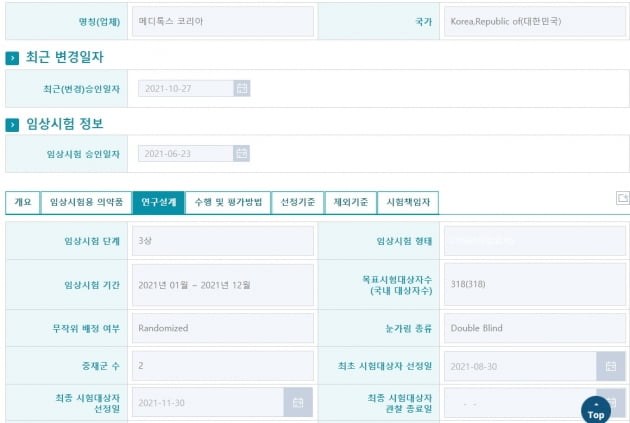
2일 식품의약품안전처의 의약품 정보 사이트 의약품안전나라에 따르면 MBA-P01의 3상 최종 시험대상자 선정이 지난달 30일 이뤄졌다.
MBA-P01은 새로운 제조공정을 적용한 원액을 사용한다. 최신 기술을 적용해 생산 수율과 품질을 향상시킨 동결건조 제형의 제품이다. 보툴리눔 균주의 배양 과정에서 동물 유래 단백질 대신 비동물성 원료를 사용한 점도 특징이다.
메디톡스코리아는 지난 6월 식약처로부터 MBA-P01의 임상 3상을 승인받았다. 올 8월 말부터 피험자 모집을 시작해 약 3개월 만에 총 318명을 모집했다. 임상은 중앙대병원 강북삼성병원 건국대병원 서울아산병원 등 네 곳에서 진행된다. 중등증 및 중증의 미간주름 개선이 필요한 성인을 대상으로 보톡스와 MBA-P01의 유효성과 안전성 등을 16주간 비교하게 된다. 임상이 예정대로 진행될 경우, 빠르면 내년 하반기 제품 출시가 가능할 것으로 보고 있다.
MBA-P01은 메디톡스코리아가 보툴리눔 톡신 제제 사업을 강화하기 위해 2016년 개발에 착수한 제품이다. 계열사인 메디톡스코리아를 통해 개발해, 허가취소 처분을 받은 메디톡스 제품들에 대한 불확실성을 해소할 것으로 기대 중이다. 식약처 허가취소 처분을 받은 메디톡스의 메디톡신 이노톡스 코어톡스 등은 현재 법원의 집행정지 판결로 판매 중이다. 최종 허가취소 여부는 본안 소송에서 결정된다.
MBA-P01이 출시되면 메디톡스는 최악의 상황이 발생하더라도, 매출 공백을 메울 수 있다. 메디톡스는 메디톡스코리아 지분 100%를 보유 중이다. 메디톡스코리아의 매출이 연결 재무제표 기준으로 메디톡스 실적에 반영되는 것이다.
국내 임상 3상과 별개로 MBA-P01은 국내 2상도 진행 중이다. 호주에서 임상 2상을 완료했지만 미국과 유럽 등 선진국 시장 진출을 위한 임상 데이터를 추가로 확보하기 위해서다.
세계 보툴리눔 톡신 시장은 2019년 51억달러(약 6조원)에서 연평균 13%씩 성장해 2025년 100억달러(약 12조원)가 될 것으로 전망된다. 미국과 유럽, 중국의 시장 규모가 약 90%를 차지하고 있어 이들 국가로의 진출은 필수적이라고 메디톡스 측은 설명했다.
한민수 기자
관련뉴스














