최근 우려는 백토서팁의 문제로 보기 어렵다고 판단했다. 연초 중앙약사심의위원회(중앙약심)는 메드팩토의 백토서팁과 ‘키트루다’ 병용 비소세포폐암 1차 치료 목적 임상 2상 용량 변경 신청에 대해 부결 의견을 결정했다. 중앙약심은 임상에서 나타난 부작용이 용량 변경을 통해 해결 가능한지에 대해 의문을 표시했다. 이에 백토서팁에 대한 우려가 확산됐다.
이동건 연구원은 “해당 이슈는 백토서팁 자체의 문제로 보기 어렵다”며 “스티븐스-존슨증후군(SJS)과 독성표피괴사용해(TEN)는 키트루다 단독요법에서도 보고된 바 있고, 이전까지 백토서팁 단독으로 약물성 간손상이 보고된 사례는 없었기 때문”이라고 말했다.
다수의 면역관문억제제와 관련 부작용 발생 간의 연관성을 분석한 결과, 키트루다뿐만 아니라 ‘임핀지’ ‘옵디보’ ‘티센트릭’ 등 대다수의 면역관문억제제들과 부작용 발생이 상관관계를 지님이 논문을 통해 확인됐다고도 했다.
또 면역관문억제제 치료에서는 면역 관련 이상반응(irAE) 발생 환자에게서 치료 효과가 더 높다는 연구결과들도 있다고 덧붙였다.
이 연구원은 “연초 중앙약심 이후 식품의약품안전처로부터 동일한 면역항암제(키트루다)와 다른 적응증(대장암)에 대한 용량 변경 신청이 받아들여졌고, 협력사와도 문제없이 올 하반기 3상 개시 준비를 진행하고 있다”고 했다.
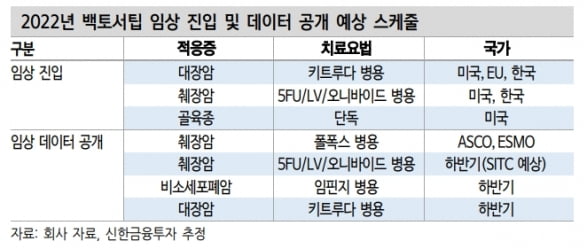
하반기부터는 백토서팁의 상업화를 위한 개발이 빠르게 진행될 것으로 기대했다. 메드팩토는 하반기에 키트루다 병용 대장암 3상, ‘오니바이드’ 병용 췌장암 2상, 백토서팁 단독 골육종 1b·2상 등 세 가지 암종을 대상으로 허가용 임상을 개시할 예정이다.
이 연구원은 “지난해 미국임상종양학회(ASCO)를 통해 우수한 효능을 입증한 대장암에 이어, 올 하반기 주요 학회들을 통해 췌장암 임상 결과를 공개할 것”이라며 “이를 바탕으로 빠르게 백토서팁의 상업화를 위한 개발이 진행될 예정”이라고 말했다.
이어 “목표주가 4만8000원에는 보수적으로 하반기 중 허가용 임상 개시를 앞둔 대장암과 췌장암 병용요법 가치만 포함했다”며 “모두 하반기 중 임상을 개시하고, 2025년 상업화를 가정했다”고 설명했다.
김예나 기자 yena@hankyung.com
관련뉴스














