<svg version="1.1" xmlns="http://www.w3.org/2000/svg" xmlns:xlink="http://www.w3.org/1999/xlink" x="0" y="0" viewBox="0 0 27.4 20" class="svg-quote" xml:space="preserve" style="fill:#666; display:block; width:28px; height:20px; margin-bottom:10px"><path class="st0" d="M0,12.9C0,0.2,12.4,0,12.4,0C6.7,3.2,7.8,6.2,7.5,8.5c2.8,0.4,5,2.9,5,5.9c0,3.6-2.9,5.7-5.9,5.7 C3.2,20,0,17.4,0,12.9z M14.8,12.9C14.8,0.2,27.2,0,27.2,0c-5.7,3.2-4.6,6.2-4.8,8.5c2.8,0.4,5,2.9,5,5.9c0,3.6-2.9,5.7-5.9,5.7 C18,20,14.8,17.4,14.8,12.9z"></path></svg><i>국내 제약·바이오 종목 가운데 1주일 동안 가장 ‘핫(hot)’하고 ‘콜드(cold)’했던 종목을 쏙 뽑아 들여다봅니다. <한재영의 바이오 핫앤드콜드>는 매주 토요일 연재됩니다.</i>8월 16~19일 제약·바이오 종목 가운데 시장 관심을 가장 많이 받은 종목은 헬릭스미스입니다.
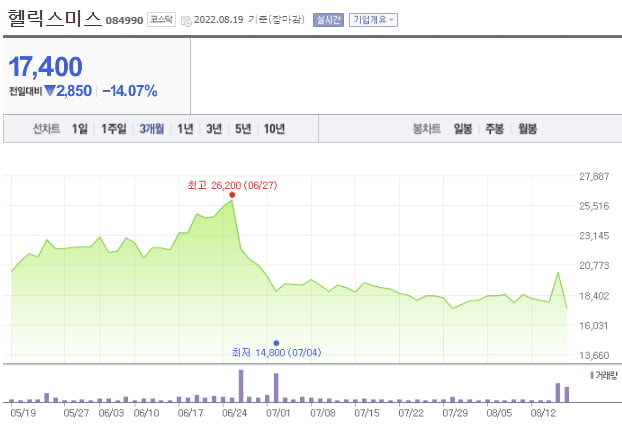
헬릭스미스 주가는 지난 18일 13.45% 급등했다가 이튿날 14.07% 하락하며 롤러코스터를 탔습니다. 급등했던 주가가 하루 만에 상승폭을 그대로 반납하며 제자리로 돌아왔습니다.
1만7850원(17일)이던 주가는 2만250원(18일)까지 치솟았다가 다시 1만7400원(19일)으로 되돌아갔습니다.
주가를 들었다 놓은 건 18일 공시입니다. 이날 헬릭스미스는 주력 파이프라인인 당뇨병성 신경병증 치료제 '엔젠시스(VM202)' 임상 3-2상에 대한 중간 분석과 관련한 공시를 했습니다.
시장이 기다리고 기다리던 공시였는데, 이날 공시는 많은 투자자들의 고개를 갸우뚱하게 만들었습니다.
공시 내용이 ①, ②, ③ 중 하나로 나올 거라고 회사가 그간 줄기차게 투자자들에게 얘기해서 그럴 줄 알았는데 ①, ②, ③도 아닌 ④의 답변이 나왔기 때문입니다.
주가가 18일 급등했다가 다음 날 급락한 것도 투자자들이 공시가 호재인지 악재인지 판단이 잘 서지 않았기 때문으로 보입니다.

엔젠시스는 어떤 약?
엔젠시스는 유전자 치료제입니다.간세포성장인자(HGF·Hepatocyte Growth Factor) 가운데 특정한 두 종류의 HGF를 발현하도록 설계됐습니다. HGF728와 HGF723입니다.
간세포성장인자는 우리 몸이 새로운 혈관을 만드는 데 기여합니다. 세포가 죽어버리는 걸 막는 작용도 합니다.
엔젠시스는 HGF 단백질이 우리 몸에 생기도록 하는 치료제입니다.
몸 속에서 유전자 정보 전달체 역할을 할 수 있는 고리 모양의 플라스미드 DNA(pDNA)에 HGF 유전자를 끼워넣는 방법을 통해서입니다.
다른 여러 전달체 가운데 pDNA를 활용하는 게 엔젠시스의 차별점입니다. '유전자가 아니라 만들어 놓은 HGF 단백질 자체를 주사하면 안되냐'고 하지만, 단백질 형태로 넣으면 체내 지속 시간, 즉 반감기가 너무 짧아 약으로 쓰는 데 한계가 있다고 합니다.
엔젠시스를 근육주사로 투여받으면 HGF 단백질이 몸 속에서 대량 생산되겠죠. 유전 정보가 들어갔으니까요. 이렇게 생성된 HGF는 'C-Met'이라는 수용체와 결합하는데, C-Met 다양한 세포에 여러 형태로 존재합니다.
HGF가 어디에 있는 C-Met과 결합하느냐에 따라 항염증 작용을 할 수도 있고, 항섬유화 작용을 하기도 합니다. 신생 혈관을 만드는 작용을 하기도 하고요.
엔젠시스는 이걸 당뇨병의 대표적 합병증인 당뇨병성 신경병증을 치료하는 목적으로 사용하려는 겁니다.
당뇨병을 오래 앓으면 신경계에도 문제가 생기는데, 특히 말초신경계에서 문제가 많이 생기기 때문입니다. 발이 저리거나 감각이 없기도 하고, 심한 통증을 동반하기도 합니다.
헬릭스미스는 HGF 유전자를 넣어 다양한 C-Met과 붙는 원리로 당뇨병성 신경병증 외에 근육이 굳는 루게릭병, 희귀 질환인 샤르코마리투스병 치료제도 개발 중입니다.
회사는 "단순 증상 개선이 아니라, 근본 원인을 고칠 수 있는 유전자 치료제"라고 강조합니다.
무슨 공시이길래
투자자들을 혼란에 빠뜨린 공시는 '독립적 데이터 모니터링 위원회(IDMC)'로부터 받은 엔젠시스 임상 3-2상 중간분석 결과에 관한 공시입니다. IDMC는 임상이 진행 중인 약물에 대해 안전성과 효능 데이터를 모니터링하는 전문가 집단입니다. 엔젠시스 임상에 대해 IDMC는 ①임상을 지속할 지 ②임상 설계 상 환자 수를 늘릴지 ③임상을 중단할지를 권고합니다.
IDMC는 당초 지난 6월 엔젠시스의 임상 3-2상 중간 모니터링 결과에 따라 권고 내용을 발표할 예정이었지만 지금까지 미뤄져 왔습니다. 헬릭스미스에 임상 데이터를 검증할 추가 데이터를 요청하는 과정 때문에 다소 늦어졌다고 합니다.
헬릭스미스는 총 152명을 대상으로 엔젠시스 임상을 하고 있습니다.
헬릭스미스에 따르면 IDMC는 절반인 76명에 대해 우선적으로 안전성과 효능을 확인한 후 ①152명을 목표로 임상을 그대로 지속할지 ②임상 환자를 더 늘릴지 ③임상을 중단할지 여부를 권고할 예정이었습니다.
어디까지나 '권고' 사항이어서 강제력은 없지만, IDMC의 권고는 굉장한 힘을 갖기 때문에 엔젠시스의 운명을 쥐고 있는 이벤트였습니다.
참고로 지난 2019년 IDMC는 신라젠의 간암 치료제 '펙사벡' 임상 3상에 대해 중단 권고를 내린 바 있습니다. 실제로 임상이 중단됐고요. 알려진 바와 같이 IDMC의 권고 이후 신라젠의 펙사벡 임상 3상은 사실상 실패로 받아들여지고 있습니다.
그런데 IDMC는 헬릭스미스의 엔젠시스에 대해 세 가지 선택지 중 하나가 아닌 제4의 코멘트를 내놓았습니다. 회사도 예상하지 못했던 피드백이었다고 합니다.
헬릭스미스 공시 중 주요 내용을 그대로 옮겨보겠습니다.
"중간분석 데이터와 헬릭스미스가 데이터의 잠재적 이상 여부 검수를 위해 취한 조치들에 대한 요약 리뷰를 검토하였다. 현재 위약군과 투약군 간의 차이를 증명할 수 있는 최소 숫자인 152명에 대한 등록이 거의 완료되었고, DSMB(Data Safety Monitoring Board) 리포트에 따르면 그룹 간의 이상 반응(Adverse Event)에서 차이가 없으므로, IDMC는 헬릭스미스에게 계획대로 (추가) 중간분석을 진행하고, IDMC가 계속 진행 여부를 결정할 수 있도록 그 데이터를 제공할 것을 권고한다."
회사와 전문가가 보는 IDMC 코멘트의 의미는
IDMC 코멘트를 놓고 헬릭스미스는 "중간 분석에 대한 판단을 유보한 게 아니다. 최종 목표인 152명까지 환자를 거의 다 모집했으니, 152명까지 다 모아서 이에 대해 분석을 해볼지 논의해보자는 명확한 답변을 준 것"이라고 했습니다.전체 임상 목표 숫자인 152명 중 절반인 76명에 대한 임상 데이터를 IDMC가 모두 들여다 봤고 ③번, 즉 임상 중단 권고를 내리지 않았다는 점을 강조합니다.
"안전성이나 유효성에 심각한 문제가 있었다면 임상 중단 권고를 했을텐데 이런 내용은 없다"고 주장하고 있습니다.
76명에 대한 임상 데이터를 들여다 본 IDMC가 과거 신라젠처럼 임상 중단 권고를 내리지 않은 건 유효성, 적어도 안전성 측면에서는 문제가 없다고 봤기 때문일 것이라는 '추정'입니다.
실제로 IDMC는 안전성과 관련해 위약군과 대조군 그룹 간 '이상반응(Adverse Event)'에 차이가 없다고 명시했다고 합니다.
이를 두고 헬릭스미스는 "IDMC가 엔젠시스가 안전하다고 판단했다"고 했습니다. 효능에 대해서도 별다른 코멘트가 없었던 만큼 "IDMC의 권고와 같이 임상을 지속하겠다"고 했습니다.
한 전문가는 "예상했던 세 가지 중 권고안이 나오진 않았지만, 기본적으로 안전성에는 이슈가 없기 때문에 임상을 지속해보라는 의미로 해석된다"며 "악재로 보긴 어렵다"고 했습니다.
다른 전문가도 "뭔가 클리어(clear)하진 않지만 임상이 지속될 가능성이 커보인다"고 했습니다. 76명이 아닌 152명까지 다 모아 놓고 이에 대해 효능 판단 여부 결정이 이뤄질 것이라는 설명입니다.
헬릭스미스는 현재 149명까지 환자 모집을 완료했습니다. 이달 말 기준으로 155명 정도가 등록될 것으로 회사는 보고 있습니다.
조금 다른 의견도 있습니다. IDMC가 사실상 판단을 유보했다는 겁니다.
IDMC가 안전성, 특히 유효성을 판단할 만큼 충분한 통계적 근거가 마련되지 않았기 때문에 추가 분석을 협의해보자는 언급을 했을 수 있다는 겁니다.
실제로 중간분석 대상자 76명 가운데 20%는 코로나19 확진 등으로 임상 대상에서 배제됐다고 합니다. 모수가 줄어들면 통계적인 유의성을 확보하는 데 어려움이 있을 수 있습니다.
국내 바이오벤처의 임상개발본부장은 "추가 중간분석을 진행할 지 논의해보자고 한 것은 유효성 측면에서 임상적으로든 통계적으로든 기대했던 결과가 나오지 않아서 좀 더 임상을 진행해 보고 유효성을 다시 보자고 한 것으로 보인다"고 했습니다.
다만 이 전문가도 안전성 면에서는 IDMC도 임상을 중단할 만한 이슈가 없다고 본 게 맞다고 했습니다.
다른 회사의 사업개발 부문장은 "IDMC는 늘 명확한 답변을 준다. '계속해라' '중단해라'라고 명쾌하게 답을 주지 않고 별도의 코멘트를 준 건 통계적으로 자체 기준에 부합하지 않는 요소가 뭔가 있었기 때문일 것"이라고 추정했습니다.
헬릭스미스, 앞으로 계획은
그러면 엔젠시스 임상은 앞으로 어떻게 될까요. 이번 IDMC 코멘트로 진행되고 있던 임상이 바뀌는 건 없다는 게 헬릭스미스의 입장입니다.
IDMC 코멘트대로 임상 대상자를 152명(실제로는 160여명에 육박)까지 모두 등록한 후 사실상 최종 분석과 같은 중간 분석을 할 지를 헬릭스미스가 결정하게 됩니다. 결정은 헬릭스미스가 하지만 분석 자체는 IDMC가 한다고 합니다.
만약 중간 분석을 하기로 결정이 났다면 마지막 환자의 6개월 추적 관찰까지 마무리된 시점에 IDMC가 통증 자료 데이터를 받아 추가 분석을 하게 됩니다.
헬릭스미스 관계자는 "내년 상반기 중에는 모든 환자에 대한 분석 결과가 나올 것으로 보인다"며 "당초 예상했던 임상 완료 시점에 큰 변화가 없다"고 했습니다.
만약 152명에 대한 임상 데이터로 IDMC가 결론을 내리기 어려울 정도로 정보가 불충분하다면 IDMC는 임상 대상자 추가 모집을 권할 수도 있다고 합니다.
한재영 기자 jyhan@hankyung.com
관련뉴스














