현대차증권은 13일 레고켐바이오에 대해 항체약물접합체(ADC) ‘LCB14’의 유방암 임상 1상 중간 결과가 고무적이라고 평가했다. 오는 12월 발표될 추가 투약 결과가 기대된다고 했다.
LCB14는 ‘HER2’를 표적하는 ADC다. 지난 8일 ‘World ADC 2022’에서 협력사인 포순제약이 진행 중인 중국 임상 1상 중간 결과를 발표했다. HER2 양성 유방암 환자 대상 임상 1a상 결과 및 1b상 중간 결과다.
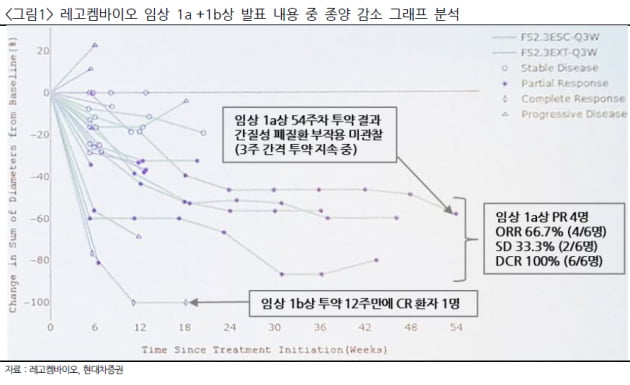
임상 1a상 중 6명의 환자에 체중 1kg당 2.3mg의 LCB14를 투약한 환자군(코호트)에서 질병통제율(DCR) 100%를 기록했다. 6명 중 4명에서 30% 이상 종양이 감소하는 부분관해(PR)가 나왔다. 나머지 2명은 암이 더 이상 커지지 않은 안정병변(SD)이 관찰됐다.
안전성도 확인했다. 2.3mg 용량을 최대 54주차까지 약 19회 반복 투약한 결과 간질성폐질환(ILD) 부작용이 나타나지 않았다.
엄민용 연구원은 “간질성폐질환은 엔허투의 사망 위험을 높이는 고질적 부작용”이라며 “LCB14 임상에서는 간질성폐질환이 발견되지 않아 향후 장기 투여 및 엔허투 내성 환자에 대한 투약이 가능할 것으로 기대된다”고 말했다.
임상 1상에서 임상 2상 권장용량(RP2D)인 2.3mg을 투여한 환자는 1a상 참여 환자 6명을 포함해 총 24명이다. 24명 중 SD는 10명이 관찰됐다. 또 12주차 투약을 마친 1명에서 완전관해(CR)가 나왔다.
아스트라제네카의 1세대 ADC인 전이성 유방암 치료제 ‘엔허투’의 임상 1상 결과와 비교해도 기대감이 높다고 했다.
엔허투는 1상에서 체중 1kg당 0.8~8mg을 투여하는 6개 코호트에 대해 용량상승시험을 실시했다. 5.4mg 투약군 6명 중 1명이 CR을, 4명이 PR을 기록했다. 5.4mg 투약군 ORR은 83.3%였다. 투약 인원을 늘린 1b상에서는 5.4mg 코호트 51명 중 CR 2명 및 PR 24명을 기록했다. ORR은 51%다.
엄 연구원은 “엔허투 1상 결과는 현재 발표된 LCB14의 중간 결과보다 우수하지만, LCB14의 1b상은 아직 진행 중”이라며 “지난 7월 데이터 집계(cut off) 시점에서 SD에 머무른 환자들이 향후 PR로 나올 경우 엔허투 임상 1b상 결과보다 좋게 나올 수 있다”고 했다.
LCB14의 1b상 환자에 대한 3~4개월 추가 투약 결과는 오는 12월 샌안토니오유방암심포지엄(SBAC)에서 발표될 예정이다.
박인혁 기자 hyuk@hankyung.com
관련뉴스














