한올바이오파마는 내달부터 상반기 안으로 중요한 임상 결과 발표를 앞두고 있다. 회사의 주력 후보물질인 ‘HL161(HBM9161)’의 중국 중증근무력증(MG) 3상 결과가 발표될 예정이다. 하버바이오메드와 석약제약그룹(CSPC)이 늦어도 2분기 초반까지 임상 결과를 발표하고, 올 상반기 안에 중국 품목허가신청서(BLA)를 제출할 것으로 예상했다.
엄민용 연구원은 “HL161은 중국에서 MG 치료제로 희귀의약품 지정(ODD)을 받아 빠른 허가절차를 통해 내년 승인 및 판매를 시작할 것”이라며 “중국 MG 환자는 20만명으로 추정되며, 이는 유럽 10만명과 미국 7만명의 환자를 합산한 것을 넘는 규모“라고 설명했다.
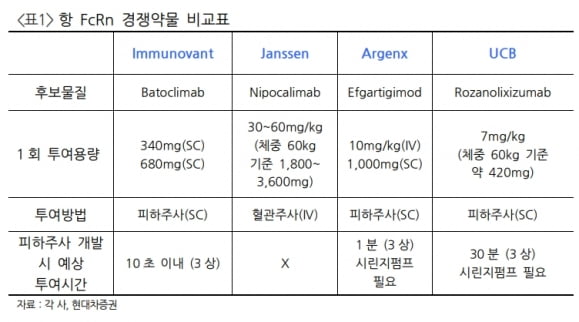
경쟁사들과 비교해 시장 진입이 빠르고, 계열내 최고(Best-in-class) 신약이 될 조건을 보유하고 있다는 판단이다. 피하주사(SC)제형인 데다 부작용 우려를 해소했고, 가장 높은 유효성을 낼 것으로 기대했다.
엄 연구원은 “경쟁약물인 아제넥스의 비브가르트 SC제형은 미국 식품의약국(FDA) 허가 지연으로 오는 6월 허가 여부가 다시 결정될 예정”이라며 “이는 중국 허가에도 영향을 미쳐 중국 진출이 늦어질 가능성이 크다“고 했다. 이에 SC제형으로는 HL161의 중국 출시 시기가 비슷하거나 빠를 수 있다고 판단했다.
얀센의 니포칼리맙(nipocalimab)은 중증 용혈성질환(HDFN) 2상에서 1차 평가 변수를 달성했고 작년 8월엔 류머티즘관절염(RA) 2상을 마쳤다. 하지만 알부민 결합에 따른 부작용 이슈를 해결하지 못 했다. 또 SC 제형이 아니라 환자편의성 측면에서 경쟁력이 떨어진다고 했다.
한올바이오파마는 올해 중반에 부작용이 없는 후속 물질 ‘IMVT-1402’의 1상 승인 및 중간결과 발표도 예상하고 있다. 엄 연구원은 “회사는 고용량 투약이 필요 없는 적응증의 경우 HL161(IMVT-1401)로 개발하고, 고용량 지속 투여가 필요한 온난항체용혈성빈혈(WHIHA) 및 기타 적응증은 IMVT-1402로 개발할 예정”이라고 설명했다.
1분기 말이나 2분기 중으로 안구건조증 치료제 ‘HL036’에 대한 하버바이오메드의 임상 여부도 다시 결정될 것으로 예상했다. 비슷한 시기에 미국 3상 결과도 공개될 것으로 전망했다.
엄 연구원은 “HL161과 HL036 임상 결과 확인된다면 우려가 모두 해소되면서 HL161의 중국 출시 및 HL036의 미국 임상 재개 등의 가치가 반영될 것”이라고 말했다.
김예나 기자 yena@hankyung.com
관련뉴스














