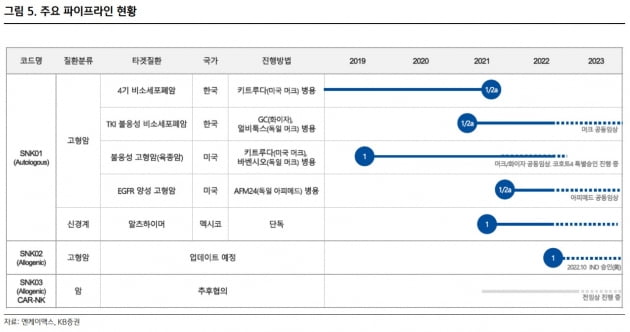
엔케이맥스는 티로신키나제억제제(TKI) 불응성 비소세포폐암, 육종암, 알츠하이머 등 5종의 적응증에 대한 임상 단계 후보물질을 보유하고 있다. 임상국 연구원은 "차별화된 자연살해(NK)세포 배양증식 기술, 양호한 임상 1상 중간 데이터, 다양한 임상 등을 기반으로 도약할 가능성이 커지고 있다"고 말했다.
상반기에 육종암 관련 자가 NK세포 치료제 'SNK01' 1상의 최종 결과 발표를 예상했다. 현재 키트루다 및 바벤시오와 각각 병용요법 임상을 진행 중이다. 1상 병용투여군 중간 결과(15명 중 CR 1명, PR 1명, SD 8명)에 이어 최종에서도 긍정적 데이터 도출에 대한 기대감이 커지고 있다고 했다.
TKI 불응성 비소세포폐암 임상 1·2a상 중간 결과는 오는 6월 초 발표될 예정이라고 전했다. 올해는 동종 NK세포 치료제인 'SNK02'의 임상도 시작된다고 했다. 위암과 고형암을 대상으로 각각 한국 1·2a상과 미국 1상을 지난해 승인받았다.
SNK01은 또 알츠하이머 1상 중간결과에서 안전성과 유효성을 확인했다고 했다. 지난달에는 국내 바이오 기업 최초로 미국 식품의약국(FDA)으로부터 파킨슨병 환자 치료를 위한 동정적 사용 승인(EAP)을 받았다. 임 연구원은 "SNK01이 뇌 속 면역세포로 작용해 치료 효과가 확인되면, 글로벌 최초 퇴행성뇌질환 NK세포 치료제 개발 기업으로 부각될 수 있을 것"이라고 판단했다.
미국 자회사 엔케이젠바이오텍은 뉴욕증권거래소에 상장된 그라프스팩과 합병을 앞두고 있다. 빠르면 올해 3분기에 상장을 추진할 예정이라고 했다. 그는 "상장 이후 글로벌 빅파마와 임상 탄력 가속화 및 재무구조 개선, 기업가치 증대가 빠르게 이뤄질 것"이라고 예상했다.
한민수 기자 hms@hankyung.com
관련뉴스














