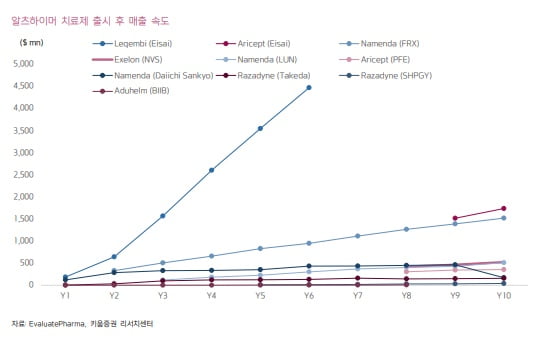
지난 9일(현지시간) 열린 미국 식품의약국(FDA) 자문위원회(Adcom) 회의에서는 ‘6대 0’ 만장일치로 알츠하이머 항체 신약 레켐비의 승인을 권고했다. FDA는 내달 6일까지 레켐비의 정식 승인을 최종결정하게 된다.
레켐비가 정식 승인을 받으면 더 넓은 보험적용에 대한 논의가 본격적으로 시작될 예정이다. 지난 1월 가속 승인을 받은 레켐비는 임상 시험 사용에 대해서만 보험이 적용된다. 레켐비의 연간 가격은 2만6500달러로, 메디케어 보장 없이 치료받기에는 높은 가격이라고 했다.
허혜민 연구원은 “메디케어메디케이드서비스센터(CMS)는 레켐비와 같은 항 아밀로이드 항체 약물이 정식 승인을 받을 경우 보험을 보장하겠다고 결정했다”며 “레켐비의 전체 승인은 메디케어 커버리지 적용을 의미한다”고 설명했다.
알츠하이머 환자들이 레켐비를 투여받게 되면서 신약 후보물질 개발 및 임상 환자 모집 등 개발 전략에 영향을 미칠 것으로 전망했다. 허 연구원은 “전임상~임상 합쳐 약 1000개 이상의 알츠하이머 치료제가 개발 중”이라며 “레켐비를 투여받은 환자에서는 레켐비 투여 이후에 신약 후보물질이 효과와 안전성을 나타낼 수 있는지 등 개발 지형 변화로 인한 전략 변경이 필요할 수 있다”고 예상했다.
CMO, 플랫폼, 진단 기업 등의 수혜도 기대했다. 알츠하이머 항체 신약은 투여 기간이 길고 용량이 높아 CMO 수요가 높을 것이란 예상이다. 허 연구원은 “삼성바이오로직스는 5공장에서 알츠하이머 블록버스터 신약의 공급을 공략한다고 밝혔다”며 “후발 주자인 릴리의 항 아밀로이드 항체 신약 도나네맙도 올해말이나 내년초 FDA의 정식 승인을 받을 것”이라고 말했다.
뇌혈관장벽(BBB) 셔틀 플랫폼을 가진 에이비엘바이오에 대한 빅파마의 관심도 증가할 것으로 예상했다.
아밀로이드베타 축적을 확인하는 진단 기술을 보유한 퓨쳐켐, 듀켐바이오, 피플바이오 등에 대한 관심도 늘 것으로 봤다. 허 연구원은 “뇌에 아밀로이드베타 축적을 확인하기 위해 새로운 스크리닝 및 진단 기술을 채택하는 데 상당한 시간이 필요하다”며 “에자이는 혈액 기반으로 알츠하이머를 진단하는 C2N과 협력했으며 레카네맙 3상 과정에 활용했다”고 설명했다.
김예나 기자 yena@hankyung.com
관련뉴스














