지놈앤컴퍼니는 식품의약품안전처에 CNTN4 표적 항암제 ‘GENA-104’의 국내 임상 1상 시험계획(IND)을 제출했다고 29일 밝혔다.
GENA-104의 국내 1상은 최대 80명의 고형암 환자를 대상으로 진행된다. 먼저 용량 증량 (Dose Escalation)을 통해 1차 목표인 안전성과 내약성을 확인한다. 이후 보충 환자군(Backfill)을 대상으로 2차 목표인 유효성을 확인할 예정이다.
GENA-104는 지놈앤컴퍼니가 자체 기술로 발굴한 CNTN4 단백질 표적 면역관문억제제다. 암세포에서 발현되는 단백질 CNTN4가 T세포 활성을 억제하는 것을 차단하는 기전이다.
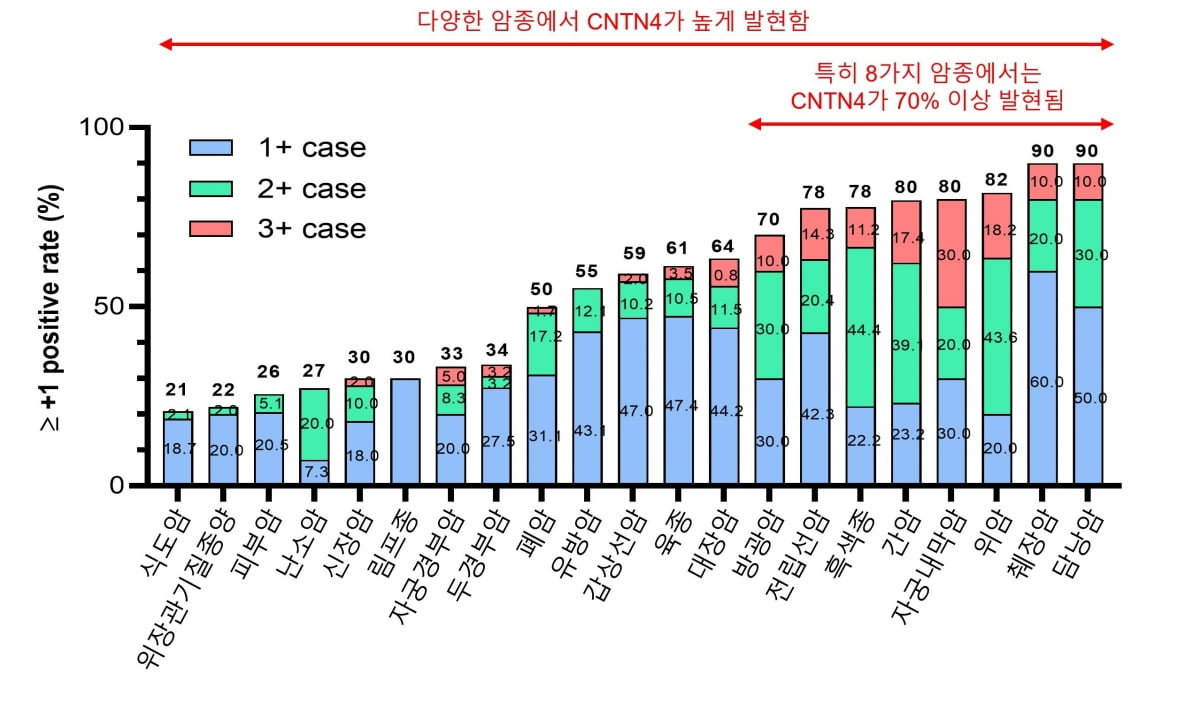
지놈앤컴퍼니는 여러 전임상을 통해 CNTN4가 다양한 종류의 암조직에서 과발현되는 것을 확인했다. CNTN4 발현이 높은 경우 PD-L1 발현이 상대적으로 감소한 경향도 확인했다.
지놈앤컴퍼니에 따르면 기존에 승인된 PD-(L)1계열 면역항암제는 치료 반응환자가 10~20%로 제한적이다. PD-L1이 발현하는 환자 수 대비 CNTN4가 발현하는 환자수가 많고, CNTN4가 과발현하는 경우 PD-L1이 발현하지 않는 배타적 발현 양상이 나타난다는 것도 특징이다.
지놈앤컴퍼니는 CNTN4 표적 항암제가 기존 면역항암제에 불응하는 환자에게 새로운 대안이 될 것으로 기대하고 있다.
배지수 지놈앤컴퍼니 대표는 “’GENA-104’ 전임상을 통해 기존 면역항암제의 비반응군 환자들을 치료할 수 있는 가능성을 확인했다”며 “’GENA-104’가 새로운 면역항암제 시장을 열 것으로 기대된다”고 말했다.
박인혁 기자 hyuk@hankyung.com
관련뉴스














