에자이는 간암치료제 '렌비마(성분명 렌바티닙)'를 출시하며 급성장한 제약사다. 이번 연구는 자사의 렌비마를 신약허가가 예상되는 HLB의 리보세라닙 병용요법을 포함해 간암 1차 치료제인 경쟁약물들의 효능과 비교분석했다.
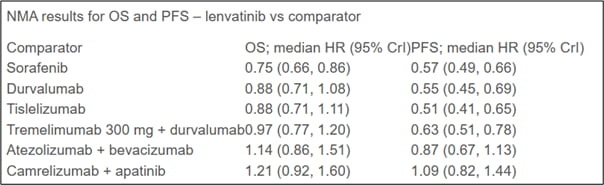
포스터 형식으로 공개된 발표 결과에 따르면 현재 간암 1차 치료제로 광범위하게 쓰이고 있는 ‘티쎈트릭+아바스틴’, ‘임핀지+이뮤도’를 비롯 ‘렌비마’, ‘넥사바’, ‘임핀지 단독’, ‘티슬리주맙(성분명)’과 비교해, 현재 미국 FDA의 본심사(NDA/BLA filing)가 진행중인 ‘리보세라닙+캄렐리주맙’ 병용요법이 최장의 환자생존기간(OS)과 무진행생존기간(PFS)을 도출해 가장 약효가 뛰어난 약물로 분석됐다. 렌비마는 기존 치료제와 유사한 수준의 생존기간을 보였다.
이번 연구는 일본 에자이의 의뢰로 영국 런던 소스 헬스 이코노믹스의 창업자인 데이비드 트루먼 박사에 의해 메타분석 형태로 진행됐다. 렌비마의 약효를 1로 설정해 비교 분석한 연구 결과, ‘리보세라닙(성분명 아파티닙)+캄렐리주맙’ 병용요법은 유일하게 OS, PFS 모두 렌비마의 약효를 넘어섰다.
연구논문 저자는 “이번 에자이의 연구 결과는 2018년 간암치료제로 허가 받은 렌비마가 여전히 치료효과가 높다는 것을 검증한 것이다”고 말했다. 에자이와 기존 표준치료제를 넘어선 치료제는 리보세라닙 병용요법이 유일하다.
최근 다양한 항암요법의 발전으로 환자 수가 급격히 줄고 있는 대부분의 암종과 달리 간암은 매년 환자수가 급격히 늘고 있어 기존 치료제의 한계를 극복할 수 있는 혁신치료제의 개발이 시급하다. 글로벌 리서치에 따르면 간암 환자수는 전 세계적으로 매년 백만 명 이상 발생하고 있으며 이중 80만 명가량이 사망한다. 간암치료제 시장은 2022년부터 2030년까지 연평균 20% 수준으로 성장할 것으로 전망되고 있다. 현재 4조 원 규모의 간암 시장은 2030년 12조 원을 훌쩍 넘을 것으로 예상된다.
‘침묵의 장기’라고 불릴 정도로 간암은 초기 치료가 어려운 대표적인 난치성 질환으로 한번 손상되면 회복이 어렵고 장기적으로 사망 가능성이 매우 높다. 블록버스터 약물로 큰 기대를 받았던 ‘키트루다+렌비마’, ‘티쎈트릭+카보메틱스’ 마저도 간암 1차 치료제 도전에서는 고배를 마셨던 이유다.
지난해 ESMO에서 글로벌 3상 결과를 발표했던 HLB는 이번 ESMO에서도 미국 자회사 엘레바 테라퓨틱스와 함께 참여했다. 특히 이번 ESMO에서는 최근 HLB가 항서제약으로부터 판권을 인수한 면역항암제 ‘캄렐리주맙’과 리보세라닙의 병용요법 관련 다수의 연구 결과도 발표돼 주목받았다.
21일 공개된 임상 3상(DRAGON IV)에서는 절제 가능한 위 및 위식도접합부위암 환자에서 수술 전 신요법(neoadjuvant treatment)으로 리보세라닙+캄렐리주맙+세포독성항암제 병용요법을 세포독성항암제를 대조군으로 진행한 임상 결과가 공개됐다. 임상 결과 리보세라닙 병용요법에서 병리학적 완전관해율(CR)이 18.3%로 대조군의 5.0%에 비교해 큰 폭의 치료 개선효과를 확인했다.
두 약물의 병용요법이 간암, 위암 등 다양한 암에서 수술 전 신요법으로 연이어 높은 치료 효과를 입증하면서 HLB는 간암 1차 치료제를 이은 후속 임상으로 수술 전 신요법을 유망한 적응증으로 검토하고 있다. 특히 늦어도 내년 5월 내 간암치료제로 허가를 받을 경우 간암에 대한 수술 전 신요법은 곧바로 글로벌 3상으로 직행할 수 있는 가능성이 높아 단시간 내 또 하나의 적응증을 확대할 수 있을 것으로 보인다.
이영애 기자 0ae@hankyung.com
관련뉴스














