 식품의약품안전처가 신약 허가 수수료를 기존 800만원대에서 4억원대로 무려 46배 인상한다. 허가 기간을 단축하고 미국 식품의약국(FDA)처럼 컨설팅까지 제공하기 위한 조치다. 하지만 바이오 벤처들의 자금난이 가중되는 가운데 대폭 인상 조치를 내놔 일각에선 볼멘소리도 나온다.
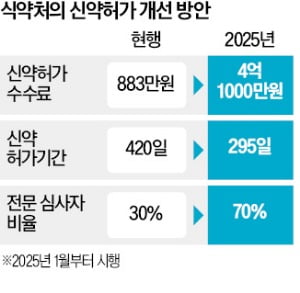
식품의약품안전처가 신약 허가 수수료를 기존 800만원대에서 4억원대로 무려 46배 인상한다. 허가 기간을 단축하고 미국 식품의약국(FDA)처럼 컨설팅까지 제공하기 위한 조치다. 하지만 바이오 벤처들의 자금난이 가중되는 가운데 대폭 인상 조치를 내놔 일각에선 볼멘소리도 나온다.식약처는 신약 허가 수수료를 건당 883만원에서 4억1000만원으로 올리고, 허가 기간도 기존 420일에서 295일로 단축하는 내용을 골자로 한 ‘의약품 등의 허가 등에 관한 수수료 규정’ 개정안을 행정 예고했다고 9일 밝혔다. 개정안은 내년 1월 시행된다.
식약처는 수익자부담 원칙에 기반한 조치라고 했다. 정책 수혜자가 비용을 부담하는 재원 마련 원칙을 뜻한다. 의사, 약사 등 전문인력 비율은 기존 30%에서 70%로 늘린다. 의약품이 사람 몸에 들어가 어떤 작용을 하는지 심도 있게 분석하기 위해서는 의사, 생리학자 등 전문인력이 필수다. 식약처 관계자는 “허가를 최대한 앞당기고, 전문성을 강화하기 위해 수수료가 글로벌 수준으로 현실화될 필요가 있다”며 “개정안이 안착되면 임상시험계획(IND) 심사 기간을 단축하는 등 확대 방안도 검토 중”이라고 말했다.
수수료를 올리더라도 심사 수준을 높여달라는 것은 업계의 오랜 요구사항이었다. FDA는 건당 50억원에 달하는 심사 수수료를 받는 대신 어떻게 임상전략을 짜야 할지 꼼꼼히 코칭해준다. 수십억원의 수수료로 몸값 높은 전문인력도 제때 채용한다. 반면 식약처는 1000만원도 되지 않는 수수료로 살림을 짰다. 보수가 낮다 보니 의사 채용공고를 내도 정원에 미달하기 일쑤였다. 한 제약사 관계자는 “어차피 허가 단계까지 이른 기업들은 임상에만 수백억원이 들기 때문에 수수료가 올랐다고 해서 허가신청을 안 하지는 않는다”며 “1년에 조 단위를 파는 약의 경우 심사 기간이 한 달 늦어지면 수천억원의 매출이 달라질 수 있는 문제”라고 말했다. 또 다른 신약개발사 대표는 “우리나라 신약 허가의 90% 이상은 다국적 제약사가 내기 때문에 오히려 터무니없이 싼 수수료는 외국회사 배만 불리는 꼴”이라고 덧붙였다.
다만 이번 개정안은 바이오기업들이 역대급 ‘투자 빙하기’에 시달리고 있을 때 나왔다는 점에서 비판의 목소리가 나온다. 이 때문에 실제 식약처 심사인력이 얼마나 늘었고 신약 허가 관련 중장기적 목표치가 어떻게 달성되고 있는지 명확히 공개할 필요가 있다는 지적이다. 업계 관계자는 “높아진 수수료만큼 신약 개발사들이 FDA 같은 도움을 받을 수 있을지 의문”이라며 “각종 목표치를 명확히 공개하고 주기적으로 점검하는 체계가 필요하다”고 말했다.
남정민/안대규 기자 peux@hankyung.com
관련뉴스














