3개월내 추가 임상정 성능시험 자료 제출해야
자가검사에 대한 추가 임상적 성능시험 자료 등을 3개월 내에 제출하는 조건이다.
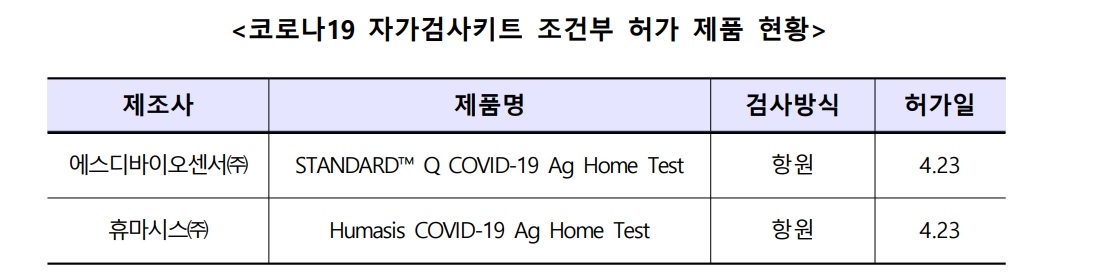
이번에 허가를 받은 두 제품은 에스디바이오센서와 휴마시스 제품으로 국내에서 전문가용으로 허가를 받았다.
에스디바이오센서 제품은 지난해 11월 임상적 민감도 90%(54/60명), 특이도 96%(96/100명)로 식약처로부터 전문가용 제조품목 허가를 받았고, 현재 독일, 네덜란드, 덴마크, 스위스, 포르투칼, 룩셈부르크, 체코 등 7개국에서 자가검사용으로 사용 중이다.
휴마시스 제품의 경우 임상적 민감도 89.4%(59/66명), 특이도 100%(160/160명)로 지난 3월 전문가용 허가를 받으며, 체코, 덴마크, 오스트리아 등 3개국이 이 제품을 자가검사용으로 사용하고 있다.
식약처 관계자는 "두 제품은 코로나19 확산 및 대유행 우려에 따라 전문가가 아닌 개인이 손쉽게 자가검사를 할 수 있는 보조적인 수단으로, 다양한 검사방법을 통해 감염 확산을 줄이기 위해 허가됐다"면서 "정식허가 제품이 나오기 이전에 한시적으로 사용하는 제품"이라고 강조했다.
두 제품 모두 자가검사용으로 코로나19 바이러스 감염 증상자의 비강 도말 검체에서 바이러스의 항원을 검출하여 검사하는 방식이고 15분 내외로 결과를 확인할 수 있다.
그러나 기존 유전자 검사(PCR) 방식 및 의료인 또는 검사전문가가 콧속 깊은 비인두에서 검체를 채취해 수행하는 항원 방식에 비해 민감도가 낮다는 단점이 있기 때문에 방역수칙을 철저히 지킨다는 전제하에 사용돼야 한다는 설명이다.
식약처는 "조건부 허가제품을 대체할 품질이 우수한 정식허가 제품의 신속 개발·허가를 적극적으로 지원해 우리 국민이 충분한 진단?치료 기회를 보장받을 수 있도록 최선을 다하겠다"고 밝혔다.
관련뉴스














