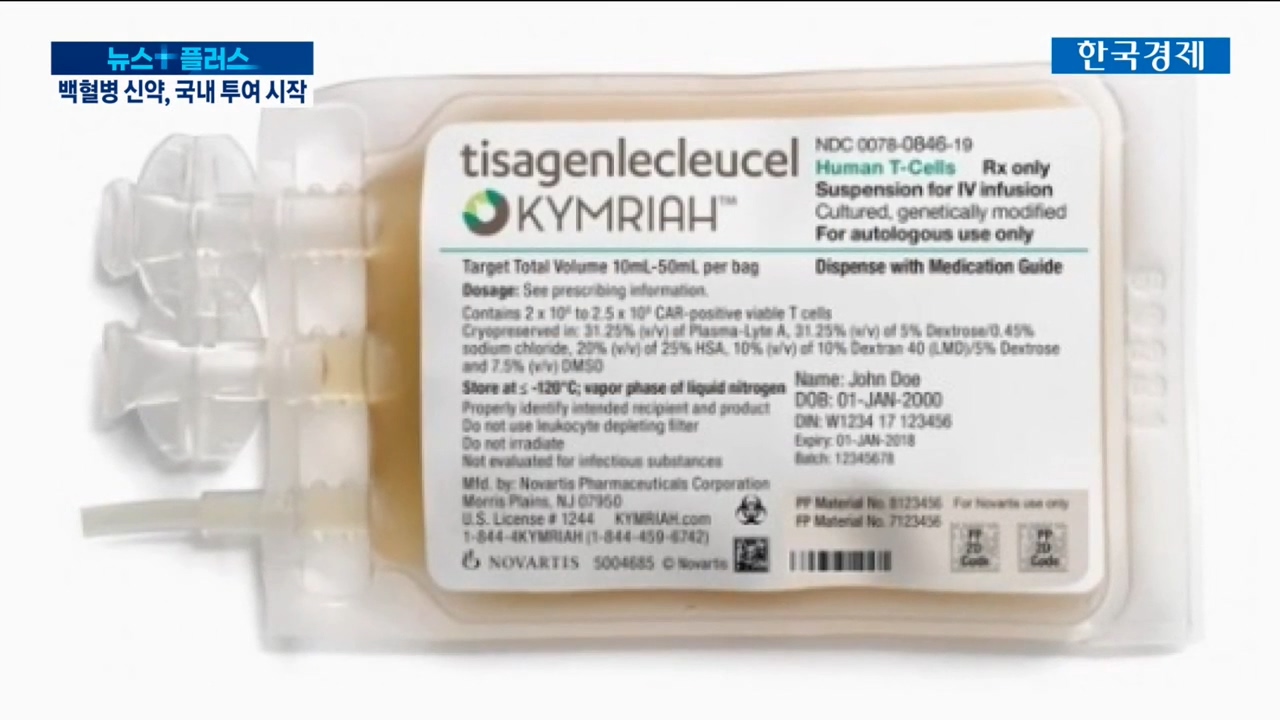
백혈병 환자들이 손꼽아 기다리는 신약이 있습니다.
바로 `카티(CAR-T)`라고 부르는 세포치료제인데 해외에서는 승인이 많이 이뤄졌지만, 국내에서는 지난 3월에 처음 품목허가를 받았습니다.
꿈의 항암제로 불리는 카티 치료제에 대해 김수진 기자가 보도합니다.
<기자>
지난 3월 식품의약품안전처는 다국적 제약사 노바티스의 CAR-T(카티) 치료제 `킴리아`를 1호 첨단바이오의약품으로 허가했습니다.
국내 대학병원들도 카티 치료에 관심이 큽니다.
삼성서울병원은 4월 말 임상시험을 통해 환자에게 카티 세포 주입을 마친 후 `CAR T-세포치료센터`를 본격 가동했고, 서울대병원 역시 최근 백혈병 환자를 위한 `병원 생산 CAR-T 치료` 임상연구계획을 보건복지부에 제출했습니다.
조혈모세포이식이 불가능한 등 뾰족한 대책이 없는 백혈병 환자가 카티 치료를 받으면 6개월 이후 생존율이 20%이하에서 60%까지 커집니다.
이렇게 효과가 좋은 이유는 환자 몸에 존재하는 면역세포(T-세포)에 암세포를 잘 찾아내는 특수 수용체(CAR)를 달아준 후 몸 안에 다시 주입, 해당 암세포를 효과적으로 죽이기 때문입니다.
대형 해외 제약사들은 카티 치료제에 치열하게 투자하고 있습니다.
글로벌에서는 노바티스의 킴리아, 길리어드 예스카타가 카티 치료제로 이미 출시됐습니다.
BMS의 아베크마는 최근 FDA 승인을 받았고, J&J 실타셀은 FDA 심사 절차에 들어간 상태입니다.
국내 기업도 개발에 속도를 내고 있습니다.
큐로셀은 지난 2월 국내 최초로 카티 치료제 임상 승인을 받았고, 앱클론은 오는 6월 말 식약처에 임상시험계획(IND)을 신청합니다.
GC녹십자셀과 헬릭스미스도 임상 준비 중이며, 에이치엘비는 카티 치료제를 개발중인 미국 베리스모테라퓨틱스 지분을 인수했습니다.
[이재원/앱클론 CFO: (카티 치료제는)빅파마들이 투자를 집중하고 있는 핫한 영역입니다. 저희도 최대한 일정을 당겨서 IND 신청 이후에 빠르면 2~3년 후에는 실제 환자들에게 투여할 수 있는 상용화 시점을 보고 있고요.]
단, 면역물질이 과다 분비되는 `사이토카인 폭풍` 같은 부작용 위험이 있고, 개인 맞춤형 치료라 킴리아 기준 1회 5억원이 넘는 고비용 치료라는 게 단점입니다.
[강형진/서울대학교 어린이병원 소아청소년과 교수 : 이게(외국산 카티가) 우리나라에 들어와도 희망고문이 됩니다. 너무 비싸서…그래서 연구중심병원에서 우리나라도 그런 세포치료제를 만들 수 있는 시스템을 갖춰야 한다는 생각이 들어서…(임상, 자체 생산으로)바로 환자에게 주게 되는거죠. 어떻게든 이 치료를 장기적으로 우리나라에서 생산하게 해야…]
국내 연구자들은 고비용 문제 해결을 위해 당분간 연구중심치료로 시간을 벌고, 그 사이 기술이전·연구지원 등으로 빠르게 국산 신약이 나와 치료 접근성을 넓혀야 한다고 설명합니다.
한국경제TV 김수진입니다.
관련뉴스