허가 내용과 규격 달라…'이중장부' 의혹 제보 접수
회사 대표 "사양 변경일 뿐…새로 허가 신청 준비중이었다"
(서울·세종=연합뉴스) 탐사보도팀 오예진 기자 = 국산 인조혈관스텐트 1위 업체가 제조판매한 혈관용 스텐트에 대해 식품의약품안전처가 '판매중지' 조치를 내렸다.
식약처는 이 업체가 허가 내용과 다른 제품을 별도 허가 없이 제조해 판매한 의혹을 포착해 조사를 진행중이다. 이에 대해 업체 대표는 '일부 사양을 변경한 것에 불과하며 새로 허가 신청을 준비중이었다'고 해명하고 있다.
13일 식약처에 따르면 정부는 지난 10일자로 ㈜에스앤지바이오텍의 혈관용 스텐트에 대해 '허가사항과 다른 의료기기'라는 이유로 회수 및 판매중지 조치를 내리고 이런 사실을 식약처 의료기기 전자민원창구 게시판을 통해 공고했다.
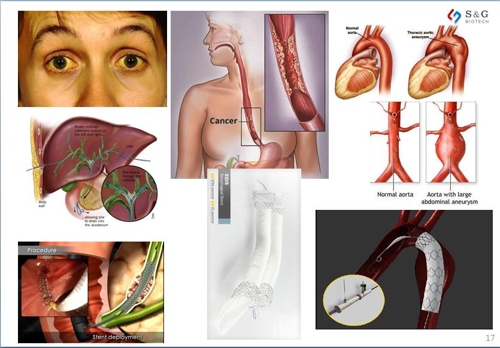
인조혈관스텐트는 혈관이 터지는 '대동맥 박리'나 터질듯 팽창하는 '대동맥류'등 관상동맥질환을 치료하기 위해 몸 속에 삽입하는 의료기기다. 그물망 모양으로 되어 있어 혈관을 넓혀 준다.
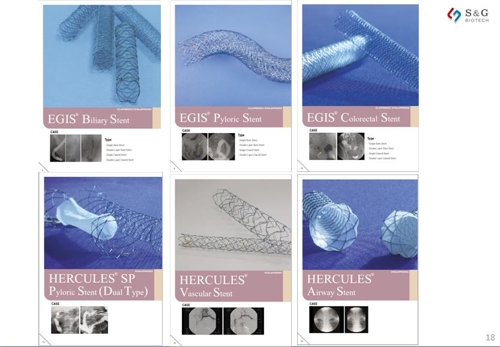
㈜에스앤지바이오텍이 작년에 공개한 투자자 상대 회사 소개 자료에 따르면 이 회사는 혈관용 스텐트 제품이 주를 이루는 스텐트 그라프트 분야에서 국내 시장점유율 43%로 국내외 업체를 통틀어 1위를 차지하고 있다.
회수·판매금지 조치가 내려진 스텐트의 품목허가 번호는 '제허 04-236호'와 '제허 07-174호'이며, 이 두 번호로 허가를 받은 제품은 모델명 기준으로 313종이다.

식약처는 지난달 말에 모 기관으로부터 첩보를 입수한 후 회사, 대리점, 거래처 등에 대한 현장 수시점검과 관련자 조사 등을 벌여 왔다.
식약처 관계자는 "사안의 중대성을 고려해 허가·비허가 여부에 관계없이 (㈜에스앤지바이오텍의 혈관용 스텐트) 제품 전체를 대상으로 우선 판매중지 조치를 했다"며 "추후 조사결과에 따라 행정처분은 물론 형사고발 조치도 검토할 계획"이라고 덧붙였다.
연합뉴스가 입수한 자료에 따르면 이 회사가 2014년부터 지난해까지 공급한 비허가 스텐트는 모두 5천348개이며 그에 따른 매출액은 146억1천500만원으로 추정된다. 공급을 받은 업체는 병원과 도소매상 등이다.
작년만 따지면 국내 74개 병원과 7곳의 도소매 업체에 33억700만원어치의 비허가 스텐트가 판매됐다.
[표] ㈜에스앤지바이오텍 비허가 판매 의혹 스텐트 수량과 금액
┌────┬─────────┬──────┬────┬──────────┐
││ 납품처 │ 기관수 │ 납품 │ 총납품액 │
├────┼─────────┼──────┼────┼──────────┤
│2014│ 병원 │ 47 │ 479 │ 14억2천100만원│
│├─────────┼──────┼────┼──────────┤
││도소매업체│ 7 │ 150 │ 1억1천900만원│
││ 및 대학기관││││
├────┼─────────┼──────┼────┼──────────┤
│2015│ 병원 │ 71 │ 832 │ 25억4천500만원│
│├─────────┼──────┼────┼──────────┤
││도소매업체│ 5 │ 86 │ 7천400만원│
├────┼─────────┼──────┼────┼──────────┤
│2016│ 병원 │ 75 │ 1077 │ 32억600만원│
│├─────────┼──────┼────┼──────────┤
││도소매업체│ 4 │ 126 │ 1억3천500만원│
├────┼─────────┼──────┼────┼──────────┤
│2017│ 병원 │ 92 │ 1222 │ 35억1천800만원│
│├─────────┼──────┼────┼──────────┤
││도소매업체│ 8 │ 291 │ 2억9천만원│
├────┼─────────┼──────┼────┼──────────┤
│2018│ 병원 │ 74 │ 905 │ 27억5천만원│
│├─────────┼──────┼────┼──────────┤
││도소매업체│ 7 │ 180 │ 5억5천700만원│
├────┼─────────┼──────┼────┼──────────┤
│총계│ │390 │ 5348 │ 146억1천500만원│
└────┴─────────┴──────┴────┴──────────┘
[연합뉴스 자체 입수 자료]
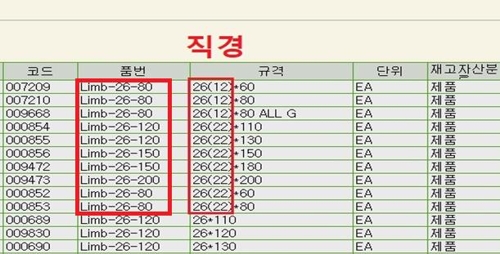
제기된 의혹에는 회사 측이 비허가 사실을 은폐하기 위해 상품박스에는 식약처 허가가 난 제품번호를 기록해 놓고 실제 박스 안에는 비허가 제품을 담아 납품하는 수법을 사용했다는 내용이 포함돼 있다.
이 과정에서 회사 직원들이 제품을 포장할 때 발생하는 혼돈을 방지하기 위해 허가가 난 제품번호 옆에 실제 제품의 규격을 따로 기입한 장부를 만들어 관리했다는 의혹과 당국의 감시를 피하기 위해 비허가 제품을 정식 제품창고가 아니라 직원휴게실이나 개인 차량 등 별도 장소에 보관했다는 의혹에 대해서도 식약처가 사실 확인 작업을 진행중이다.

강성권 ㈜에스앤지바이오텍 대표는 이런 의혹에 대해 "비허가 제조·판매는 없다"고 주장하면서 "허가 받은 제품이지만 사양이 변경된 것"이라는 입장을 밝혔다.
그는 "예를 들어 100㎜와 150㎜이 (허가로) 있는데 120㎜, 130㎜을 허가로 볼거냐 그런 것에 대한 생각을 '아, 이것은 단순 치수 변경이다'라고 해석할 수 있다"고 말했다.
㈜에스앤지바이오텍의 비허가 제품 대부분이 기존 제품에서 모양이나 크기에 약간의 변형을 준 것에 불과해 식약처에서 새로 허가받는것을 고려하지 않았다는 취지의 해명이다.
그러나 현행법상 비슷한 형태의 의료기기에 대해 허가를 받았더라도 기존 규격에서 형태를 변경한 제품은 새로 허가를 받아야 한다는 것이 식약처의 입장이다.
강 대표는 이에 대해 "최근에 그런 규정을 알게 되어서 (사양 변경 제품을) 허가 목록에 추가하려고 준비하고 있었다"고 주장했다.
이 회사 제품을 구매한 병원이나 의사들이 비허가 제품인 것을 알고서도 썼는지 여부에 대해 강 대표는 "사양이 변경된 제품은 (허가) 코드가 없었다. 그래서 허가된 코드로 (포장해서) 병원에 갖다 줬기 때문에 실제로 (수술을 맡거나 제품 사용을 결정한) 교수들은 허가 사항에 대해서는 잘 모를 것"이라고 말했다.

ohyes@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














