치료제와 달리 품목허가 후 '국가출하승인' 받아야
(서울=연합뉴스) 계승현 기자 = 식품의약품안전처는 신종 코로나바이러스 감염증(코로나19) 백신 접종 일정에 차질이 없도록 품목허가와 국가출하승인 등 절차에 속도를 내고 있다.
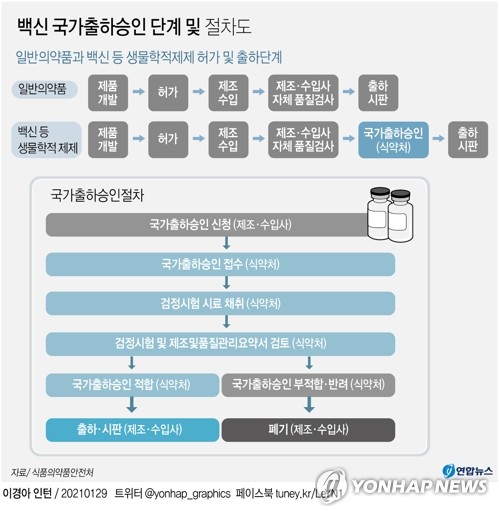
식약처는 통상 2∼3개월 걸리는 국가출하승인을 코로나19 백신에 대해서는 20일 이내로 단축할 계획이라고 29일 밝혔다.
◇ 백신에만 국가출하승인 왜?…"접종 파급력 상당"
백신은 건강한 사람에게 단기간에 대규모 접종하는 의약품인 만큼 국가가 품목허가 이후에도 품질을 다시 한번 검증하는 국가출하승인제도를 운영하고 있다.
제조단위(로트) 별 '검정시험'과 제조사가 허가받은 대로 제조하고 시험한 결과를 제출한 '자료검토' 결과를 종합적으로 평가한다.
검정시험에는 세균 등 미생물 감염 여부를 확인하는 '무균시험'과 '엔도톡신시험', 효력을 알아보기 위한 '역가시험'과 '확인시험'이 포함돼있다.
예컨대 아스트라제네카 백신의 경우 역가시험, 확인시험, 바이러스입자 함량시험 등 10종을, 화이자 백신의 경우 역가시험, 확인시험, 지질입자크기시험 등 12종을 검정시험 항목으로 예정하고 있다.
계절독감백신의 경우 무균시험 등 7개 검정시험을 수행한다.
자료검토는 로트별 제조 및 시험기록이 의약품 제조 및 품질관리기준(GMP)과 허가사항을 따르고 있는지 확인하는 것이다.
<YNAPHOTO path='GYH2021012900080004400_P2.jpg' id='GYH20210129000800044' title='' caption=''/>
◇ 아스트라제네카 지난해 8월·화이자 11월부터 준비
식약처는 병원체나 항원단백질을 사용하던 기존의 백신과 달리 코로나19 백신의 경우 바이러스벡터, mRNA 등 유전물질을 사용하는 새로운 제조 공정으로 만들어지기 때문에 더 철저한 국가출하승인이 필요하다고 설명했다.
식약처는 이를 위해 아스트라제네카 백신은 지난해 8월부터 검정시험에 필요한 상세 시험법, 시약, 장비 등을 준비해 지난해 12월 검정시험법을 마련했다.
화이자 백신도 지난해 11월부터 시험방법, mRNA 백신 분석 장비와 시약을 입수하는 등 준비를 해왔다.
식약처는 검정시험에 필요한 핵산추출기·나노입도분석기 등 첨단 분석 장비를 긴급 구매하고 RNA 백신 분석 실험실과 냉동보관 백신을 위한 보관품실 공사를 완료했다. 국가출하승인 전문인력도 보강했다.
식약처는 우리나라의 국가출하승인 역량이 국제적으로 인정받아 세계보건기구(WHO)와 협력하고 있다고 강조했다.
WHO는 2006년부터 식약처를 'WHO 위탁시험기관'으로 지정해 계절독감·일본뇌염·콜레라 백신 등의 품질검사를 의뢰하고 있다. 위탁시험기관은 영국, 독일 등 12개국 13개 기관이 지정돼있다.
지난해 7월에도 WHO와 신규계약을 체결해 BCG(결핵 예방 백신)·계절독감 백신 등 총 29로트의 위탁 품질검사를 하고 있다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














