전문가용 국내 허가받은 제품…해외선 이미 자가검사용으로 사용 중
유증상자나 역학적 연관성 있는 사람에만 사용…"보조적 수단"
(서울=연합뉴스) 계승현 기자 = 식품의약품안전처는 신종 코로나바이러스 감염증(코로나19)을 자가 검사할 수 있는 항원방식 진단키트 2개 제품을 조건부 허가했다고 23일 밝혔다.
두 진단키트는 각각 에스디바이오센서와 휴마시스[205470] 제품으로, 앞서 국내에서 전문가용으로 허가를 받았고 해외에서는 자가검사용으로 긴급사용승인을 받은 바 있다.
조건부 허가에 따라 정식 허가 제품이 나오기 전까지 두 제품을 국내에서 한시적으로 사용할 수 있게 됐다. 업체들은 임상적 성능시험 자료 등을 3개월 이내에 추가로 제출해야 한다.
식약처에 따르면 허가 후 7∼10일이 지나면 약국과 인터넷에서 구매할 수 있을 전망이다. 가격은 휴마시스와 에스디바이오센서 모두 미정이다.
식약처 관계자는 "회사들이 내부 회의를 하고 있는데, 공장 출고가가 7천원 정도라는 말이 있다"며 "시중에 나오면 소비자가격이 1만원 정도 될 것 같고, 포장 단위가 커지면 가격이 더 내려갈 것 같다"고 말했다.
허태영 에스디바이오센서 사장은 "내주 초까지 가격을 확정할 예정이다"고 말했다. 휴마시스 관계자도 "아직 정해지지 않은 상황이다"며 말을 아꼈다.
에스디바이오센서 진단키트는 독일 등 유럽 7개국, 휴마시스 제품은 체코 등 유럽 3개국에서 이미 자가검사용으로 사용 중이다.
에스디바이오센서 제품은 독일에서 자가검사용으로 실시한 임상적 성능시험 결과 민감도 82.5%, 특이도는 100%인 것으로 나타났다. 휴마시스 제품은 체코 및 브라질 시험 결과 민감도 92.9%, 특이도 99%였다.
민감도는 환자를 양성으로 판정할 확률, 특이도는 환자가 아닌 사람을 음성으로 판정할 확률이다.
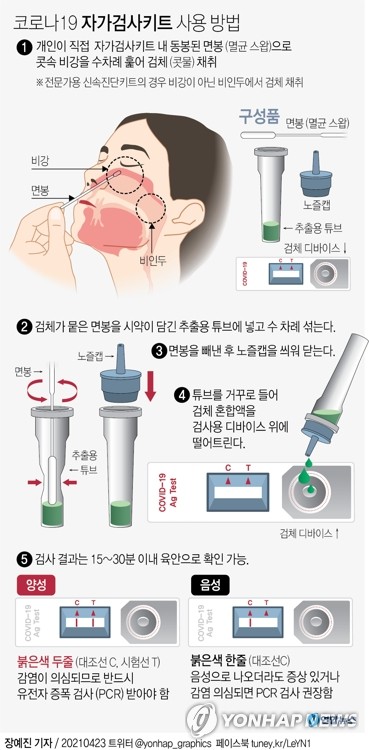
두 제품은 전문가의 도움 없이 개인이 직접 콧속에서 검체를 채취해 검사하는 방식으로 사용한다. 검사 결과는 15∼20분 이내에 맨눈으로 확인할 수 있다.
다만 기존 유전자 증폭검사(PCR) 방식 및 전문가가 콧속 깊은 곳에서 검체를 채취해 수행하는 항원 방식보다 민감도가 낮다는 단점이 있다.

이에 따라 식약처는 두 제품은 코로나19 확진용이 아닌 보조적 수단으로만 사용해야 한다고 강조했다.
무증상자보다는 증상이 있거나 역학적 연관성이 있는 사람이 PCR 검사를 하기 어려운 경우 등에 보조적으로 사용해야 한다.
붉은색 두줄(양성)이 나타나는 경우 반드시 PCR 검사를 받아야 하고, 붉은색 한줄(음성)이 나타나는 경우에도 감염이 의심되거나 증상이 있으면 PCR 검사를 받아야 한다. 확진은 PCR 결과와 임상 증상을 고려해 의사가 최종 판단해야 한다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














