암세포 공격수 '킬러 T세포', 산화 지방 먹고 기능 상실
미국 소크 연구소, 저널 '이뮤니티'에 논문
(서울=연합뉴스) 한기천 기자 = 요즘 새롭게 주목받은 '암 면역 대사'(cancer immunometabolism) 분야는, 암 종양 내에서 가용한 영양 성분의 변화에 따라 면역세포의 대사 프로그램이 어떻게 바뀌는지 연구하는 것이다.
암 종양 내에 지방에 많이 쌓이고, 이런 지방 축적이 면역 기능의 이상과 연관돼 있다는 건 어느 정도 알려진 사실이다.
하지만 종양 내 지방 증가가 어떻게 면역 이상을 유발하는지는 아직 명확히 밝혀지지 않았다.
암이 성장하고 퍼지는 전제 조건은 T세포 등 면역세포를 회피하는 것이다.
그런데 암세포 제거에 특화된 '킬러 T세포'(killer T cells)가 종양 내의 '나쁜 지방'을 흡수하면 항암 기능이 약해진다는 연구 결과가 나왔다.
종양 미세환경(종양 내 환경)에 산화된 지방 분자가 늘어나면 에너지에 굶주린 킬러 T세포가 이런 지방을 포식하게 되는 것으로 나타났다.
한마디로 산화된 '나쁜 지방'이 암의 성장을 촉진할 수 있다는 뜻이다.
이 연구를 수행한 미국 소크 연구소의 수잔 캐히(Susan Kaech) 면역학 교수 연구팀은 최근 면역학 저널 '이뮤니티'(Immunity) 온라인판에 관련 논문을 발표했다.
캐히 교수는 이 연구소 산하 NOMIS 면역생물학· 미생물병리학 센터의 이사를 맡고 있다.
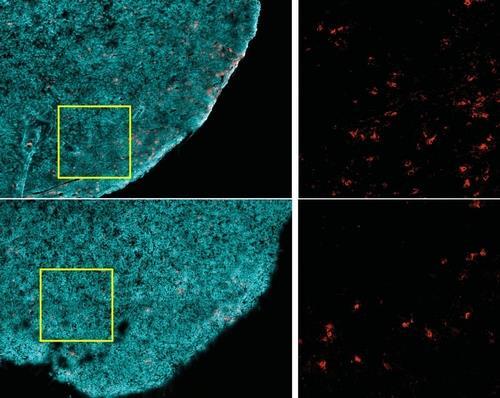
11일 미국 과학진흥협회(AAAS) 사이트(www.eurekalert.org)에 공개된 논문 개요 등에 따르면 연구팀은 암 종양 내에 몇몇 종류의 지질, 특히 산화된 지질 수위가 높다는 걸 확인했다.
이런 지질은 일반적으로 산화된 LDL(저밀도 리포 단백질)에서 발견돼 '나쁜 지방'으로 통한다.
몸에 좋은 HDL 콜레스테롤과 달리 LDL 콜레스테롤은 혈관 내벽에 쌓여 동맥경화를 유발하는 것으로 알려져 있다.
생쥐 모델에 실험한 결과, 킬러 T세포는 종양 미세환경이 변하면 자기 표면의 CD36(지방 수송체)를 늘려 더 많은 양의 산화 지질을 먹어 치웠다.
이렇게 산화 지질을 포식한 킬러 T세포는 힘이 떨어져 암세포를 제대로 공격하지 못했다.
전체적으로 이 과정은 T세포 내에서 더 많은 지질을 산화하는 촉매 역할을 했다.
연구팀은 또 CD36이 종양 내 T세포의 산화 지질 흡수를 늘리고 기능 이상을 촉진한다는 것도 확인했다.
T세포의 산화 지질 흡수가 늘면, T세포의 지질 산화도 느는 악순환이 반복됐다. 게다가 p38과 같은 스트레스 반응 단백질이 활성화했다.
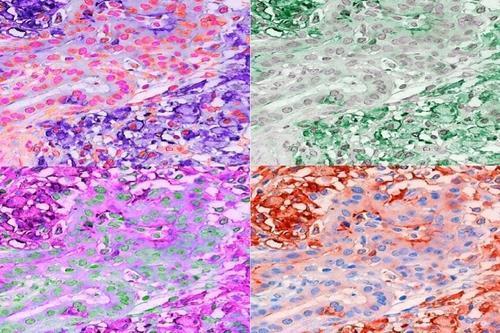
연구팀은 이런 결과를 종합해 새로운 치료 표적을 지목했다.
면역치료로 암 종양 내 지질 산화를 줄이면 킬러 T세포의 항암 기능을 되살릴 수 있다는 것이다.
치료적 접근법을 예로 들면, 항체 치료로 CD36을 억제하거나 글루타싸이온 과산화효소 4(GPX4)를 과잉 발현하게 할 수 있다고 한다.
GPX4는 세포 내 산화 지질을 제거하는 대표적 펩타이드다.
문제는 지질 산화가 T세포뿐 아니라 종양 세포에서도 일어난다는 것이다.
논문의 수석저자인 캐히 교수는 "T세포를 배제하고 종양 세포에서만 지질 산화가 일어나게 하는 선택적 접근법을 찾아야 한다"라면서 "그렇지 않으면 항암 T세포를 모두 파괴할 수도 있다"라고 지적했다.
cheon@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














