림프절 활성 단계서 유전자 이상 발현→공격 능력 못 갖춰
동물 실험서 사이토카인 투여했더니 T세포 되살아나
면역관문 차단제 병행 투여 '유력'…저널 '사이언스 이뮤놀로지' 논문
(서울=연합뉴스) 한기천 기자 = 비소세포 폐암(NSCLC)은 폐암 중 가장 흔한 유형이다.
이 유형의 폐암 환자는 면역관문 차단(ICB) 치료를 받을 수 있다. 하지만 치료에 반응을 보이는 경우는 시도한 환자의 35%에 그친다.
ICB 치료의 효과가 이렇게 떨어지게 만드는 T세포 저항 메커니즘을 미국 MIT(매사추세츠공대) 과학자들이 밝혀냈다.
ICB는 힘이 다 빠져 기능을 멈춘 것으로 추정되는 T세포에 다시 활기를 불어넣어 암세포를 공격하게 하는 것이다.
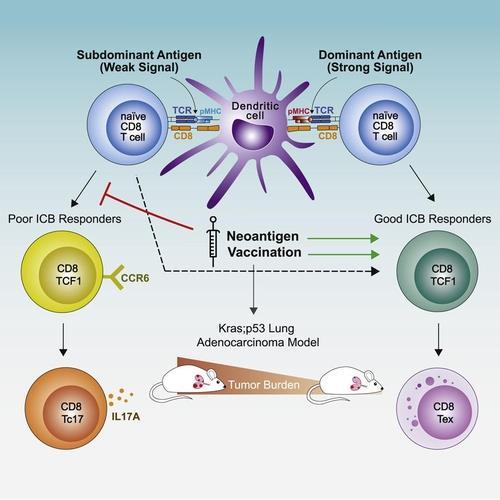
그런데 종양 내에서 암세포를 공격하지 못하는 T세포는 탈진한 게 아니라 처음 활성화될 때부터 그런 기능을 갖추지 못한 것으로 나타났다.
과학자들은 특정 사이토카인을 투여하면 이런 T세포의 암세포 공격 능력을 되살릴 수 있다는 것도 동물실험에서 확인했다.
사이토카인은 주로 백혈구에서 분비되는 단백활성 면역 조절인자를 말한다.
MIT 생물학과의 스테파니 스프랭어(Stefani Spranger) 석좌교수 연구팀이 수행한 이 연구 결과는 지난달 29일(현지 시각) 저널 '사이언스 이뮤놀로지(Science Immunology)'에 논문으로 실렸다.
지금까진 과도한 자극을 받거나 너무 오랫동안 종양과 싸운 T세포가 힘이 빠져 공격 기능을 상실하는 것으로 알았다.
과학자들은 오래전부터 종양 내의 어떤 조건이 이런 'T세포 탈진'을 일으킨다고 믿었다.
그런데 학계의 이런 통념에 오류가 있는 것으로 드러났다.
실제로 ICB에 저항하는 T세포 가운데 일부는 종양 내로 들어오기 전부터 그런 기능을 상실한다는 게 확인됐다.
이런 T세포는 암세포와 싸우다가 탈진하는 게 아니라, 림프절에서 처음 활성화될 때부터 유전자의 이상 발현으로 그런 능력을 갖추지 못했다.
일단 활성화된 T세포는 특정한 기능을 갖춘 상태로 분화하며, 유형별로 독특한 유전자 발현 패턴을 보인다.
논문의 수석저자이자 코흐 통합 암 연구소의 일원인 스프랭어 교수는 "종양 내로 들어오기 전부터 이런 T세포는 ICB 치료에 반응하지 못하는 상태였다"라면서 "이는 미리 결정된 상태라는 걸 확인했다"라고 말했다.
연구팀은 비소세포 폐암이 생기게 조작한 쥣과 동물 모델에서, ICB 치료에 반응하는 T세포와 반응하지 않는 T세포를 각각 분리해 전령RNA(messenger RNA)의 염기서열을 분석했다.
유전자 분석엔 코흐 통합 암 연구소의 크리스토퍼 러브 화학 공학 석좌교수 랩에서 개발한 '시크-웰(Seq-Well)'이라는 시퀀싱 기술을 썼다.
단일 세포의 유전자 발현 특성을 상세히 보여주는 이 기술을 적용하자, 서로 완전히 다른 유전자 발현 패턴이 드러났다.
ICB에 반응하지 않는 T세포는, 특정 사이토카인 수용체의 발현 도가 매우 낮은 것으로 분석됐다.
그러나 동물 모델의 폐종양에 사이토카인을 추가로 투여하자 비활성 T세포의 공격 능력이 되살아났다.
연구팀은 T세포 특유의 기능적 상태가 갖춰질 때 함께 결정되는 이 유전자 발현 차이가 ICB 내성과 연관돼 있다고 제안했다.
물론 이런 사이토카인 치료를 당장 인간에게 적용하긴 어렵다.
코로나19(신종 코로나바이러스 감염증) 중증 사례에서 드러났듯이 '사이토카인 폭풍(cytokine storm)' 같은 심각한 부작용이 따를 수 있기 때문이다.
하지만 특정 유형의 암 종양에 안전하게 적용할 수 있는 사이토카인 치료법 연구가 활발히 진행되고 있다고 한다.
따라서 미래엔 면역관문 차단 치료와 사이토카인 치료를 병행하는 게 유력한 선택이 될 거로 연구팀은 기대한다.
샌디에이고 캘리포니아대(UCSD)의 제프리 블루스톤 대사 내분비학 석좌교수도 "면역관문 차단 치료에 반응하지 않는 비소세포 폐암 환자의 면역력을, 적절한 병행 치료로 살려내는 잠재적 기회를 제공한 연구"라고 평가했다.
cheon@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스














