식약처 "모든 복용환자 모니터링 할 것"
해외서도 부작용 이유 임상 중단 드물어
[ 조미현 / 김근희 기자 ]
 늑장 공시 의혹, 신규 환자 처방 금지 등으로 위기에 내몰렸던 한미약품이 한고비를 넘겼다. 식품의약품안전처가 한미약품 폐암 치료제 ‘올리타(성분명 올무티닙)’의 조건부 판매 허가를 유지하기로 했기 때문이다. 부작용의 심각성보다 환자 치료 효과가 더 크다는 판단에서다. 신약 개발의 어려움과 특수성을 감안한 조치다.
늑장 공시 의혹, 신규 환자 처방 금지 등으로 위기에 내몰렸던 한미약품이 한고비를 넘겼다. 식품의약품안전처가 한미약품 폐암 치료제 ‘올리타(성분명 올무티닙)’의 조건부 판매 허가를 유지하기로 했기 때문이다. 부작용의 심각성보다 환자 치료 효과가 더 크다는 판단에서다. 신약 개발의 어려움과 특수성을 감안한 조치다.올리타의 부작용 논란으로 자칫 신약 개발에 급브레이크가 걸릴 뻔한 국내 바이오·제약업계도 안도하는 분위기다. 이번 올리타 부작용 논란과 관련해 전문가들은 항암제 임상시험 과정에 대한 이해가 필요하다고 조언했다.

◆올리타, 신규 환자도 처방 가능
식약처는 4일 올리타의 임상시험 3상은 물론 신규 환자 처방을 허용하기로 했다고 발표했다. 올리타는 기존 치료제에 내성이 생긴 중증 폐암 환자가 복용하는 약이다.
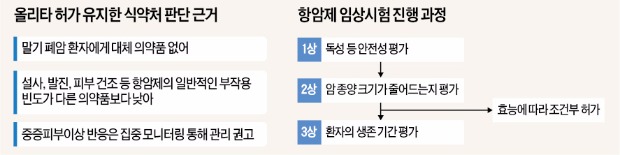
이날 열린 중앙약사심의위원회는 “부작용이 나타났지만 치료에 실패한 말기 폐암 환자에게 유익성이 크다”고 식약처 자문에 답했다.
식약처는 지난달 30일 올리타 임상환자 가운데 한 명이 중증 부작용으로 사망한 것으로 판명되자 신규환자에 대한 처방을 금지 했었다. 식약처는 이 약을 복용하는 모든 환자를 집중 모니터링하기로 했다. 이상반응이 나타났을 때 신속하게 공유할 수 있도록 의사와 환자에 대한 교육도 이뤄질 예정이다.
이원식 식약처 의약품안전국장은 “임상 과정에서 예측하기 어려운 부작용이 나타날 수 있다”며 “초기에 이상반응을 발견하도록 조치를 강화할 것”이라고 설명했다.
◆임상시험 특수성 이해해야
전문가들은 의약품 임상시험에서 부작용이 나타난다고 해서 무조건 개발을 중단하는 일은 드물다고 설명한다. 항암제는 설사, 발진, 가려움증 등 부작용이 다양하고 심한 것으로 알려져 있다.
사람을 대상으로 약의 안전성과 효능을 살펴보는 임상시험은 1~3단계로 이뤄진다. 1단계인 임상 1상에서는 독성 등 치료 물질이 안전한지 평가한다. 2상에서는 효능·효과를 따져본다. 항암제는 2상에서 암 종양 크기가 줄어드는지를 살핀다. 3상에서는 대규모 환자를 대상으로 종합적인 평가가 이뤄진다. 기존 치료제를 썼을 때보다 생존 기간이 얼마나 늘어나는지를 보는 것도 항암제 임상시험 3상의 중요한 요소다.
지금은 대표적인 폐암 치료제로 꼽히는 아스트라제네카의 이레사도 임상 과정에서 부작용으로 논란을 낳았다. 2002년 일본에서 이레사를 처방받은 환자 80여명이 간질성 폐렴이라는 부작용으로 잇따라 사망했다. 하지만 한국 등 다른 나라에서는 부작용을 면밀히 관찰하면서 투약이 이뤄졌다.
이대호 서울아산병원 종양내과 교수는 “미국에서 2005년 이레사의 판매 허가가 취소된 것은 기존 치료제보다 효능이 없다고 밝혀졌기 때문이지 부작용이 원인이 아니었다”며 “이후 특정 유전자 변이를 공격하는 데 효능이 있다는 새로운 연구 결과를 토대로 지난해부터 판매 허가가 다시 나왔다”고 전했다.
◆“바이오산업 성숙 계기 돼야”
한미약품은 이번 식약처 결정으로 안도하는 분위기다. 판매 중지나 허가 취소 결정이 나왔다면 내년 8월까지로 예정된 올리타의 글로벌 임상에도 차질이 빚어질 수 있기 때문이다. 한미약품 관계자는 “식약처와 중앙약사심의위원회 결정에 따라 성실하게 안전관리 조치를 이행해 나가겠다”고 말했다.
국내 제약·바이오업계는 이번 사태를 한국 바이오산업이 성숙하는 계기로 삼아야 한다고 강조한다. 신약 개발에 대한 지나친 장밋빛 기대나 근거 없는 의구심을 경계해야 한다는 지적이다.
서정선 한국바이오협회 회장은 “한미약품의 신약 개발 노력은 국내 바이오·제약기업에 모범이 돼 왔다”며 “이번 일로 연구개발(R&D) 등 바이오·제약산업이 위축돼서는 안 될 것”이라고 말했다.
조미현/김근희 기자 mwise@hankyung.com
관련뉴스














