아시아 10개국서도 글로벌 임상
"안전성 입증…성공 자신"
[ 김근희 기자 ]
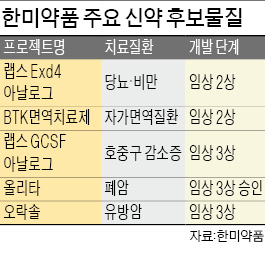 지난해 기술수출 계약 해지, 부작용 등으로 홍역을 치른 한미약품의 폐암 신약 ‘올리타정’(성분명 올무티닙)이 국내 임상 3상 승인을 받았다. 환자 사망 등 부작용 때문에 어려움을 겪은 한미약품이 폐암 신약 개발에 속도를 내게 됐다는 분석이 나온다.
지난해 기술수출 계약 해지, 부작용 등으로 홍역을 치른 한미약품의 폐암 신약 ‘올리타정’(성분명 올무티닙)이 국내 임상 3상 승인을 받았다. 환자 사망 등 부작용 때문에 어려움을 겪은 한미약품이 폐암 신약 개발에 속도를 내게 됐다는 분석이 나온다.13일 제약업계에 따르면 식품의약품안전처는 한미약품이 개발한 폐암 치료제 올리타정의 임상 3상 시험계획을 승인했다. 올리타정은 암세포 성장에 관여하는 신호전달 물질인 ‘상피세포 성장인자 수용체(EGFR)’ 돌연변이만을 골라 억제하는 폐암 표적항암제다. 지난해 5월 시판 후 임상 3상 실시 및 자료 제출을 조건으로 조건부 허가를 받았다. 국내에서 개발해 허가된 27번째 신약이다.
하지만 올리타정을 기술이전받은 다국적 제약사 베링거인겔하임이 기술수출 계약을 해지하는 과정에서 부작용 논란이 일었다. 한미약품은 베링거인겔하임이 하던 올리타정의 글로벌 임상 2상을 넘겨받고 국내 임상도 무리 없이 추진하겠다고 밝히기도 했다.
한미약품은 임상 3상에서 기존 표적항암제에 내성이 생겨 더는 치료할 수 없는 비소세포폐암 환자를 대상으로 올리타정의 유효성을 평가할 예정이다.
한미약품은 아시아 유럽 등 해외에서도 올리타정 임상 3상에 나설 계획이다. 폐암 유병률이 높은 아시아 10여개국에서 글로벌 임상 3상에 나설 것으로 알려졌다. 회사 측은 글로벌 임상 국가와 임상 실시기관은 공개하지 않았다.
올리타정의 임상 3상 승인으로 부작용 등 약물 안전성 논란에서 벗어날 것으로 보인다. 일각에서는 항암제 부작용이 일반적인데도 국내에서 지나치게 과민반응했다는 지적이 나온다. 다국적 제약사 아스트라제네카의 폐암 치료제 ‘타그리소’는 임상 과정에서 간질성 폐질환 등 부작용으로 4명의 사망자가 나왔는데도 부작용 논란에 휩싸이지 않았다. 한미약품 관계자는 “이번 허가로 안전성 이슈는 완전히 해소됐다”며 “국내에서 배출한 글로벌 혁신 신약 1호가 될 수 있도록 임상에 최선을 다하겠다”고 말했다.
김근희 기자 tkfcka7@hankyung.com
기업의 환율관리 필수 아이템! 실시간 환율/금융서비스 한경Money
관련뉴스














