3세대 크리스퍼 상용화 길 열려
선천성 실명 환자 18명 시험
[ 이지현 기자 ] 3세대 유전자가위인 크리스퍼를 몸속에 넣어 선천성 안질환을 고치는 치료제 개발 가능성이 열렸다. 미국 바이오기업 에디타스메디슨과 아일랜드 제약사 앨러간이 미 식품의약국(FDA)으로부터 사람 대상 임상승인을 받으면서다. 지금까지 허가받은 유전자편집 연구는 몸밖으로 세포를 꺼내 유전자를 편집한 뒤 다시 넣어주는 방식이었다. 유전자가위 연구가 한 단계 도약했다는 평가다.
크리스퍼 체내 임상, 세계 첫 승인
에디타스메디슨과 앨러간은 최근 FDA로부터 크리스퍼 유전자가위 체내 임상시험 승인을 받았다. 상용화를 위한 세계 첫 연구다. 에디타스메디슨은 미 매사추세츠공대(MIT)와 하버드대 합작 브로드연구소가 2013년 세운 회사다. 이들은 유전성 희귀 안질환인 레베르 선천성 흑암시(LCA) 환자 18명에게 유전자가위 등을 넣어 유전자를 편집하는 임상 1·2상 시험을 할 계획이다. LCA는 유년기 실명을 일으키는 대표 유전질환이다. 세계적으로 출생아 10만 명당 2~3명 정도가 앓는 것으로 추정된다. 생후 1년 안에 증상이 나타나 시력이 떨어지고 심하면 실명하지만 마땅한 치료제가 없다.
LCA 환자의 20~30% 정도는 특정 유전자(CEP290) 돌연변이 때문인 것으로 알려졌다. 에디타스메디슨은 이 부분에 주목했다. 올 하반기부터 환자 망막에 크리스퍼 기반 치료제(AGN-151587)를 주사해 돌연변이를 치료할 계획이다. 잘못된 유전자를 고치는 근본 치료법이기 때문에 주사는 한 번만 맞으면 된다. 업계에서는 크리스퍼 유전자가위 연구가 한 단계 도약했다고 평가했다. 윤태종 무진메디 대표(아주대 약학과 교수)는 “지금까지는 줄기세포 등을 밖으로 꺼내 유전자 편집 처리를 한 뒤 다시 넣는 방법이었다”며 “유전자 편집이 가능한 물질을 몸속에 바로 넣어 질환 부위에 도달하도록 한 뒤 편집한다는 점에서 차이가 있다”고 했다.
“크리스퍼 연구 진일보” 평가
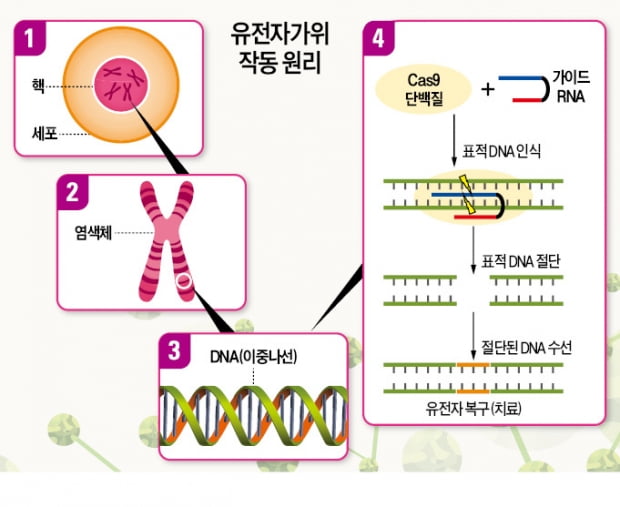
유전자 편집은 유전체 안의 특정한 DNA를 인식해 자르고 교정하는 기술이다. 유전자를 자르는 물질에 따라 1세대 징크핑거뉴클레이즈, 2세대 탈렌, 3세대 크리스퍼 등으로 구분된다.
유전자 편집 기술은 몸밖에서 편집한 세포를 몸속으로 넣어주는 방식과 몸속에 직접 편집 물질을 넣어주는 방식으로 나뉜다. 지난해 미국 바이오회사 크리스퍼테라퓨틱스와 버텍스는 FDA로부터 몸밖에서 크리스퍼로 편집한 세포를 넣어주는 치료제 임상허가를 받았다. 혈액 질환자들의 조혈모 세포를 꺼내 유전자를 편집한 뒤 넣어주는 방식이다.
체내 편집은 이보다 난도가 높다. 몸속으로 들어간 유전자가위가 다른 부위를 자를 가능성이 있기 때문이다. 면역계가 이물질로 인식하는 유전자가위를 질환이 생긴 부위까지 운반하는 것도 문제다. 이번 임상연구를 통해 이런 체내 유전자 편집 기술에 대한 우려가 어느 정도 해소될 것으로 업계에서는 기대했다.
툴젠 등 국내 업체 개발 활발
이번 기술은 앞서 중국에서 문제가 된 사람 배아 유전자 편집과도 다른 형태다. 윤 대표는 “중국에서 진행된 연구는 질환이 생기지 않은 배아의 유전적 상태를 변형시켜 사람을 태어나게 했기 때문에 인류 다양성을 해치는 등 윤리적 논란이 있었다”며 “질환이 생긴 사람을 치료하기 위해 유전자를 활용하는 것과는 차이가 있다”고 했다.
생명공학정책연구센터에 따르면 지난해 4조860억원 규모인 유전자 편집 시장은 2023년 8조370억원으로 확대될 것으로 전망된다. 국내 업체들도 치료제 개발에 뛰어들었다. 제넥신과 합병을 선언한 툴젠은 크리스퍼 유전자가위 특허를 보유하고 있다. 무진메디는 체내 유전자 편집을 위한 운반 및 가이드 기술을, 지플러스생명과학은 식물 유전자 편집 기술 등을 활용해 제품을 개발하고 있다.
■유전자 편집
유전체 안의 특정한 DNA를 인식해 자르고 교정하는 기술. 특정 염기서열을 인지해 해당 부위의 DNA를 절단하는 유전자가위가 대표적이다. 유전병 및 난치질환 치료, 동·식물 품종 개량 등에 활용된다.
이지현 기자 bluesky@hankyung.com
관련뉴스














